在抗肿瘤免疫反应中,细胞毒性T细胞(CTL)和自然杀伤细胞(NK细胞)是核心的“免疫战士”。T细胞通过其表面的T细胞受体(TCR)特异性识别肿瘤细胞表面的抗原肽-MHC复合物,并在共刺激分子的激活或共抑制分子的调控下发挥抗肿瘤作用;而NK细胞则通过表面的共刺激和共抑制分子直接与肿瘤细胞上的配体结合,调节其杀伤功能。免疫突触(IS)的形成是免疫细胞与肿瘤细胞“对决”的关键环节,它通过粘附功能增强肿瘤与免疫细胞的相互作用,并利用共刺激分子促进免疫细胞的活化。然而,肿瘤细胞常常通过多种机制逃避免疫系统的攻击,例如抗原呈递途径的下调1,以及免疫抑制分子如PD-L1和SERPINB9的上调等2,3。但肿瘤细胞如何通过免疫突触实现免疫逃逸,这一机制仍不明确。
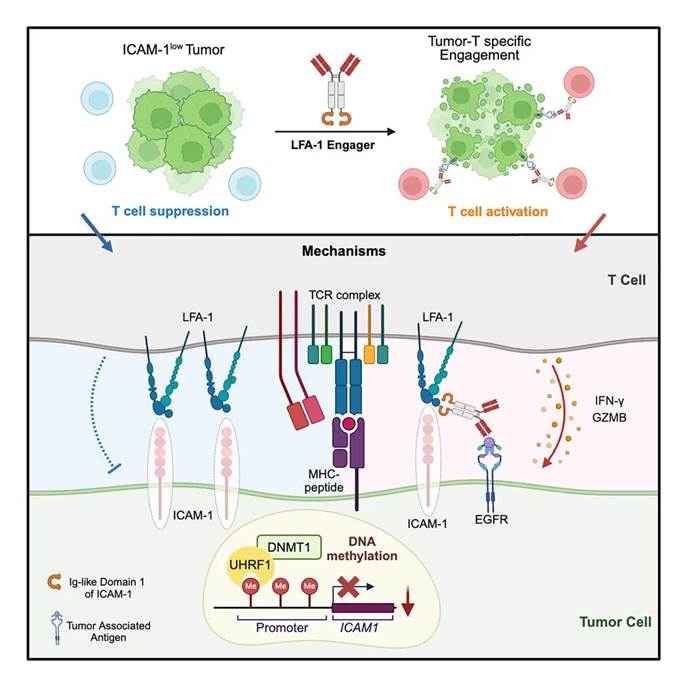
2025年2月24日,清华大学基础医学院潘登以及北京大学定量生物学中心曾泽贤团队合作,在Cell Reports Medicine上发表了题为“Potentiating anti-tumor immunity by re-engaging immune synapse molecules”的研究论文,发现肿瘤通过抑制免疫突触/共刺激分子ICAM-1的表达介导了肿瘤的免疫逃逸。在分子机制方面,通过CRISPR全基因库筛发现,肿瘤ICAM-1的表达受到UHRF1/DNMT1所涉及的DNA甲基化途径的负调控。为克服这种免疫逃逸,研究团队设计了一种名为“LFA-1接合器”的新型双特异性抗体。这种抗体能够在肿瘤与T细胞表面重塑ICAM-1/LFA-1信号轴,从而提升T细胞对肿瘤细胞的杀伤能力。在小鼠荷瘤模型中,LFA-1接合器显著增强了免疫细胞介导的细胞毒性与效应功能,并与免疫检查点阻断(ICB)疗法产生了协同效应。

通过对多个数据库的分析,研究者发现ICAM-1——一种参与免疫突触形成及共刺激信号的关键分子,在多种人类和小鼠肿瘤中表达水平较低,甚至完全缺失。免疫检查点阻断(ICB)临床试验数据进一步揭示,ICAM-1的表达水平与患者的ICB治疗响应率呈正相关,同时也会影响肿瘤内T细胞和NK细胞的浸润程度。进一步研究发现,肿瘤细胞中ICAM-1的缺失显著增强了对CTL细胞和NK细胞介导的抗肿瘤免疫的耐受性。在小鼠荷瘤实验中,ICAM-1敲除的肿瘤生长更具优势,其体积也显著大于对照组。此外,无论肿瘤是否表达MHC-I分子,ICAM-1均能参与小鼠的抗肿瘤免疫过程。
为深入探究肿瘤细胞中ICAM-1表达的调控机制,研究团队利用CRISPR全基因组筛选发现,ICAM-1的表达受到多种表观遗传机制的调控,其中UHRF1/DNMT1介导的DNA甲基化途径发挥了关键作用,并在多种肿瘤细胞中表现出保守性。具体而言,UHRF1通过其SRA结构域识别ICAM1启动子区域的CpG位点甲基化,并借助DNA甲基化修饰,从而抑制ICAM1的转录和表达。进一步研究表明,靶向DNA维持性甲基化途径可以上调肿瘤细胞中ICAM-1的表达,显著增强CTL细胞和NK细胞的细胞毒性功能,进而提升对肿瘤细胞的杀伤效果。
为应对肿瘤通过下调ICAM-1表达实现的免疫逃逸,研究团队设计了一种名为“LFA-1接合器”的双特异性抗体。该抗体旨在同时靶向肿瘤细胞的肿瘤相关抗原(TAA)和T细胞的LFA-1分子。实验结果显示,LFA-1接合器能够在肿瘤细胞和T细胞表面重塑ICAM-1/LFA-1信号轴,显著增强了T细胞的抗肿瘤功能。此外,该接合器还可重塑肿瘤免疫微环境,特异性激活肿瘤内浸润T细胞的分化和功能,并可协同抗PD-1治疗进一步提升机体的抗肿瘤免疫能力。
本研究不仅揭示了免疫突触介导的免疫逃逸机制及其关键分子ICAM-1的调控方式,还为基于ICAM-1的肿瘤免疫治疗提供了新的思路和重要的实验依据。通过重新激活免疫突触相关信号,LFA-1接合器有望为肿瘤免疫治疗开辟新的道路。未来,随着相关研究的不断深入,这种新型抗体疗法有望走向临床,为肿瘤患者带来更有效的治疗选择。
参考文献:
1. Zaretsky, J.M., Garcia-Diaz, A., Shin, D.S., Escuin-Ordinas, H., Hugo, W., Hu-Lieskovan, S., Torrejon, D.Y., Abril-Rodriguez, G., Sandoval, S., Barthly, L., et al. (2016). Mutations Associated with Acquired Resistance to PD-1 Blockade in Melanoma. N Engl J Med 375, 819–829. https://doi.org/10.1056/nejmoa1604958.
2. Burr, M.L., Sparbier, C.E., Chan, Y.-C., Williamson, J.C., Woods, K., Beavis, P.A., Lam, E.Y.N., Henderson, M.A., Bell, C.C., Stolzenburg, S., et al. (2017). CMTM6 maintains the expression of PD-L1 and regulates anti-tumour immunity. Nature 549, 101–105. https://doi.org/10.1038/nature23643.
3. Jiang, P., Gu, S., Pan, D., Fu, J., Sahu, A., Hu, X., Li, Z., Traugh, N., Bu, X., Li, B., et al. (2018). Signatures of T cell dysfunction and exclusion predict cancer immunotherapy response. Nat Med 24, 1550–1558. https://doi.org/10.1038/s41591-018-0136-1.

曾泽贤团队 :http://cqb.pku.edu.cn/zenglab/
现任北京大学前沿交叉学科研究院定量生物中心、北大-清华生命联合中心研究员,博士生导师。主要聚焦肿瘤免疫学,有机结合数据挖掘与生物技术(干湿结合),研究肿瘤免疫调控机制与免疫细胞互相作用,揭示肿瘤免疫反应机理,旨在为临床免疫治疗成功率的提高提供新的靶向基因,探究肿瘤免疫调控机理。在Immunity、Cell Metabolism、Cancer Discovery、Science Advances、Nucleic Acids Research等刊物上发表一作或通讯作者论文20余篇。