在健康细胞中,蛋白质的生成与清除处于微妙而精确的动态平衡之中。作为维持蛋白质稳态的核心装置,蛋白酶体负责识别并降解那些已损伤、错误折叠或不再需要的蛋白质。通过对底物蛋白泛素标记进行定向清除,蛋白酶体能有效阻止有毒蛋白聚集的堆积,守护细胞最基本的运行秩序。
然而,一旦蛋白酶体的功能出现失衡,细胞内部的蛋白质清除系统便会随之紊乱。未能及时被处理的错误折叠蛋白会不断积累,最终形成难以逆转的病理沉积。这一过程已被证实与多种神经退行性疾病的发生密切相关。
因此,深入理解蛋白酶体在真实细胞环境中的动态结构特征、互作网络及其在不同亚细胞区室内承担的差异化功能,是阐明神经退行性疾病发病机制的一个关键科学问题。而以往对蛋白酶体的结构研究大多在体外纯化条件下进行,无法体现其在活细胞中的真实全貌。
2025年11月28日,北京大学化学与分子工程学院、北京大学定量生物学中心、北大-清华生命科学联合中心唐淳教授团队与中国科学院大连化学物理研究所张丽华团队,在Nature Communications 上发表题为《In-situ Cross-Linking Mass Spectrometry Reveals Compartment-Specific Proteasomal Interactions and Structural Heterogeneity》的研究论文,首次利用原位交联质谱技术,在完整细胞环境中系统解析了人源26S蛋白酶体在不同亚细胞区室(细胞核与细胞质)的构成差异、互作网络与结构动态特征。这项工作也为克服动态复合物结构的人工智能预测中的瓶颈提供了实验解决方案。
研究团队开发并运用了一种细胞膜渗透性的交联剂,成功在活细胞内对蛋白酶体及其相互作用蛋白进行“冻结”和“拍照”。有赖于蛋白质在细胞中的极高浓度,这种方法能捕获到传统方法难以观察到的微弱、瞬时的相互作用。结合细胞核-细胞质精细分离技术以及人工智能结构建模,他们为细胞内的蛋白酶体绘制了一幅高精度的“三维互动地图”。
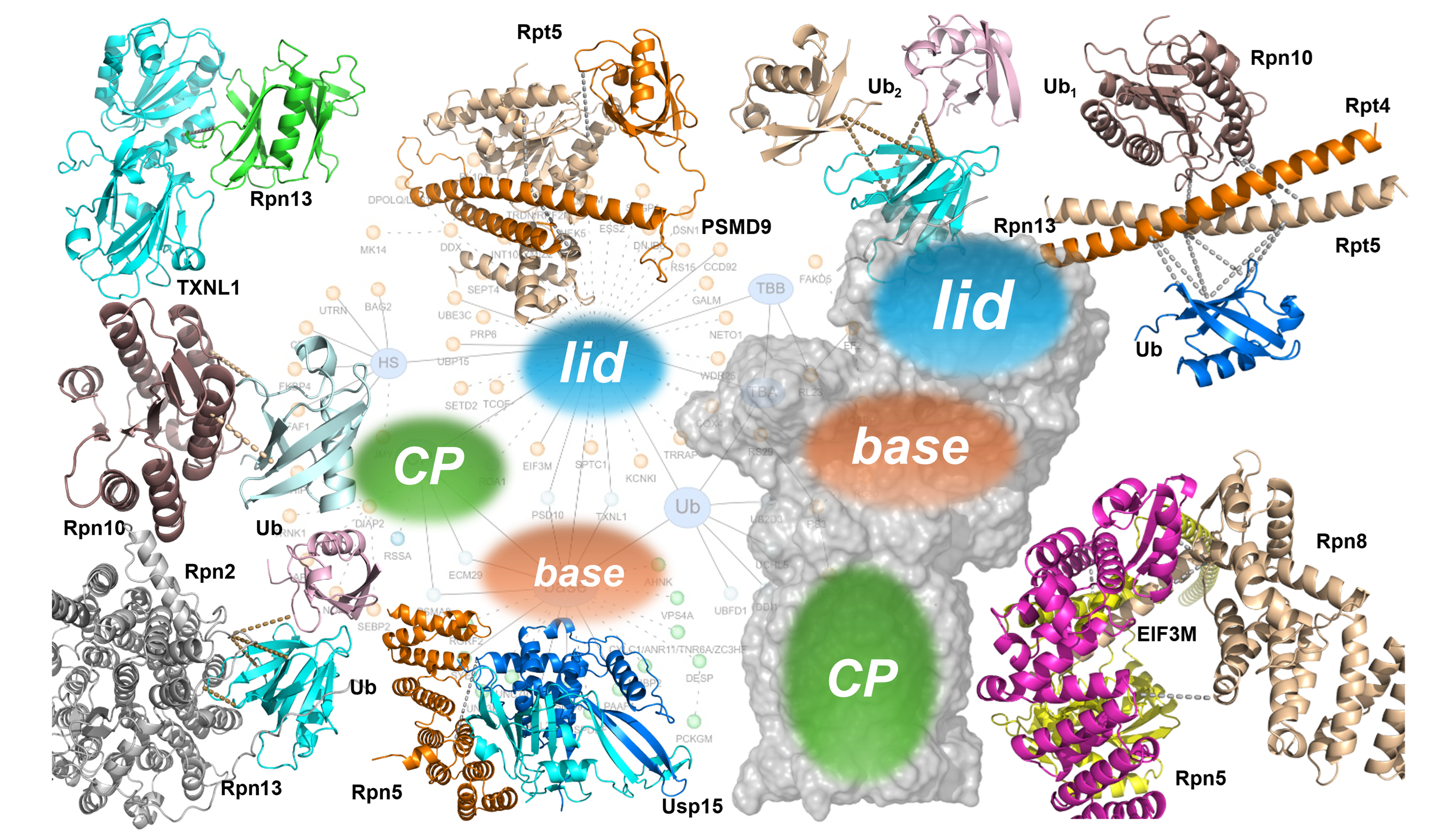
结果显示,蛋白酶体在不同亚细胞区室中呈现出显著的组成差异和构象多样性,同时伴随独特的互作组和动态状态,这一复杂性远超体外纯化体系所能再现的水平。另一方面,研究团队不仅鉴定到新的与泛素相关的蛋白酶体亚基,还发现了区室特异性的泛素结合模式和泛素化特征。这些差异提示蛋白酶体在细胞核与胞质中可能降解不同类型的底物,执行着截然不同的蛋白质稳态调控策略。
在此基础上,研究者进一步鉴定出多种此前未被报道的蛋白酶体互作因子,其中包括去泛素化酶USP15,它可能作为蛋白酶体上第四种驻留的去泛素化酶,精细调控底物的降解过程。此外,研究还揭示了一种新型“嵌合蛋白酶体”变体:在该结构中,翻译起始因子EIF3M会替代传统蛋白酶体亚基Rpn9,从而形成特殊的亚基组合,为理解蛋白质合成与降解两大核心生命过程之间的潜在交叉调控提供了全新线索。
基于交联数据提供的氨基酸残基间的距离信息,研究团队成功构建了多个蛋白酶体瞬态互作界面与动态亚复合物的结构模型,为解析其在细胞内的活动方式提供了关键视角。这些模型揭示,细胞内的蛋白酶体构象比体外结构更为开放和动态,更好地反映了其在繁忙的细胞环境中执行任务时的真实状态。
该项工作不仅建立了研究大型蛋白复合体原位结构动态的完整技术框架,也揭示了亚细胞区室特异的结构与互作如何共同调控蛋白酶体功能,为深入理解细胞蛋白质稳态的精细调控机制、以及相关疾病的机理研究和未来药物开发提供了新的理论依据和技术支撑。
本论文的共同通讯作者为北京大学化学与分子工程学院、北京大学定量生物学中心、北大-清华生命科学联合中心唐淳教授、中国科学院大连化学物理研究所张丽华研究员与赵群研究员;共同第一作者包括中国科学院大连化学物理研究所赵丽丽,北京大学化学与分子工程学院赵润涛,以及中国科学院精密测量科学与技术创新研究院龚洲。本研究工作还受到了科技部重点研发计划和基金委重大就计划项目的支持。
论文链接:https://www.nature.com/articles/s41467-025-65752-6
唐淳课题组(北京大学化学与分子工程学院,前沿交叉学院生命科学联合中心及定量生物学中心):致力于发展并整合创新的化学生物学与生物物理技术,在原子到分子水平上定量解析生物大分子的动态结构,并阐明其在生命活动与疾病发生中的功能,特别聚焦于蛋白质稳态失衡与神经退行性疾病的分子机理。欢迎已获得或短期内可获得化学生物学、生物物理等相关专业博士学位的有志科研之士申请博士后及科研助理职位。按照北京大学相关规定执行,提供具有国际竞争力的待遇条件职位,本招聘长期有效。导师信息及相关个人页面:http://tanglab.cn (联系方式:tc@pku.edu.cn)