转录是生命体中最重要的生命活动之一,细胞对于转录的调控贯穿着从发育到衰老的整个过程,而一旦出现异常的转录调控,则有可能导致疾病的产生。研究者们很早就发现细胞核内基因组在转录时会有不同区室产生,有转录活跃的区域,也有转录抑制区域,并且这些区室在整个生命进程中是动态性变化的1。有趣的是,生物在进化发育的过程中出现了很多具有一定功能和组成的无膜结构,关于它们的形成机制一直以来并没有得到很好的解释。直到近些年“液液相分离”概念2的引入,才使得人们开始对这些无膜细胞器有了新的认识,这个概念也在帮助人们逐渐认识不同组成不同功能的转录聚集体。
FET(FUS/EWSR1/TAF15)融合蛋白可能是众多参与形成转录聚集体的转录因子中比较特殊的一部分。FET蛋白家族的成员本身都是RNA结合蛋白,但是在很多肉瘤及白血病患者体内都发现了由于染色体易位导致的新融合蛋白的形成。在这一类融合蛋白中,N端来自于FET蛋白家族的N端低复杂度结构域(Low complexity domain,LCD),C端主要来自于ETS蛋白家族的DNA结合结构域(DNA binding domain,DBD)。已经有研究表明融合蛋白的N端可以结合RNA聚合酶II(RNA polymerase II, Pol II)的C端结构域(C terminal domain,CTD),从而提高下游基因的转录水平,这可能是癌症发生的诱因之一3。2018年Robert Tjian课题组在Science杂志发表文章,他们在细胞内通过超分辨成像技术观察到FET家族融合蛋白EWS-FLI1在细胞核中形成聚集体并可以招募RNA聚合酶4。
近日,北京大学前沿交叉学科研究院定量生物学中心的齐志课题组与清华大学生命科学学院李丕龙课题组以及英国格拉斯哥大学黄旭课题组合作在Nature Communications上在线发表题为Loci specific phase separation of FET fusion proteins promotes gene transcription(FET融合蛋白在特异性靶标位点形成相分离聚集促进下游基因转录)的文章。

在该工作中,作者首先体外纯化了EWS-FLI1这一被广泛研究的FET家族融合致癌蛋白,它也是诱发尤因肉瘤(Ewing Sarcoma)的主要原因之一,以及模式体系FUS-Gal4并证明这两种蛋白在体外可以和对应的多乘DNA靶标序列形成液态相分离液滴。然后作者利用最新发展的单分子生物物理技术 – DNA帘幕(DNA Curtains)对相分离聚集体进行研究。DNA帘幕技术5可以在体外将多个单根DNA分子铆定在同一条线上,样品池底部为一层类似于磷脂双分子层的脂质体,保证了DNA及蛋白在样品池中的流动性,通过微流系统实现进样以及改变反应条件,同时这项技术也具备高通量的特点,利用全内反射荧光显微镜(Total internal reflection fluorescence microscope, TIRFM)在一次实验中对多个DNA分子和蛋白分子的运动进行记录。作者在噬菌体基因组中克隆了一段含有25´ GGAA的微卫星序列,通过对EWS-FLI1进行荧光标记,比较靶标位点处荧光强度随蛋白浓度的变化确定了EWS-FLI1和FUS-Gal4在~100 nM的浓度下就可以在靶标位点处形成具有液态性质的聚集体,并且靶标位点处形成的聚集体可以招募体外纯化的RNA聚合酶II的CTD结构域。之后,作者开发了一套基于DNA帘幕系统并依赖于FET融合蛋白聚集体体外转录的新技术。这个技术的核心想法是将来自于RNA聚合酶II的CTD部分与T7 RNA聚合酶(T7 RNAP)融合表达并体外纯化。当FET融合蛋白在靶标位点处形成聚集体后,T7 RNA聚合酶可通过RNA聚合酶II的CTD与FET融合蛋白N端的相互作用从而被招募到聚集体中起始转录。作者利用带有荧光标记的UTP对转录产物RNA进行标记和分析,发现在多乘靶标位点附近形成的聚集体处的转录活性最高,这为FET融合蛋白通过相分离参与调控转录活性提供了体外因果性的证明(见图1)。
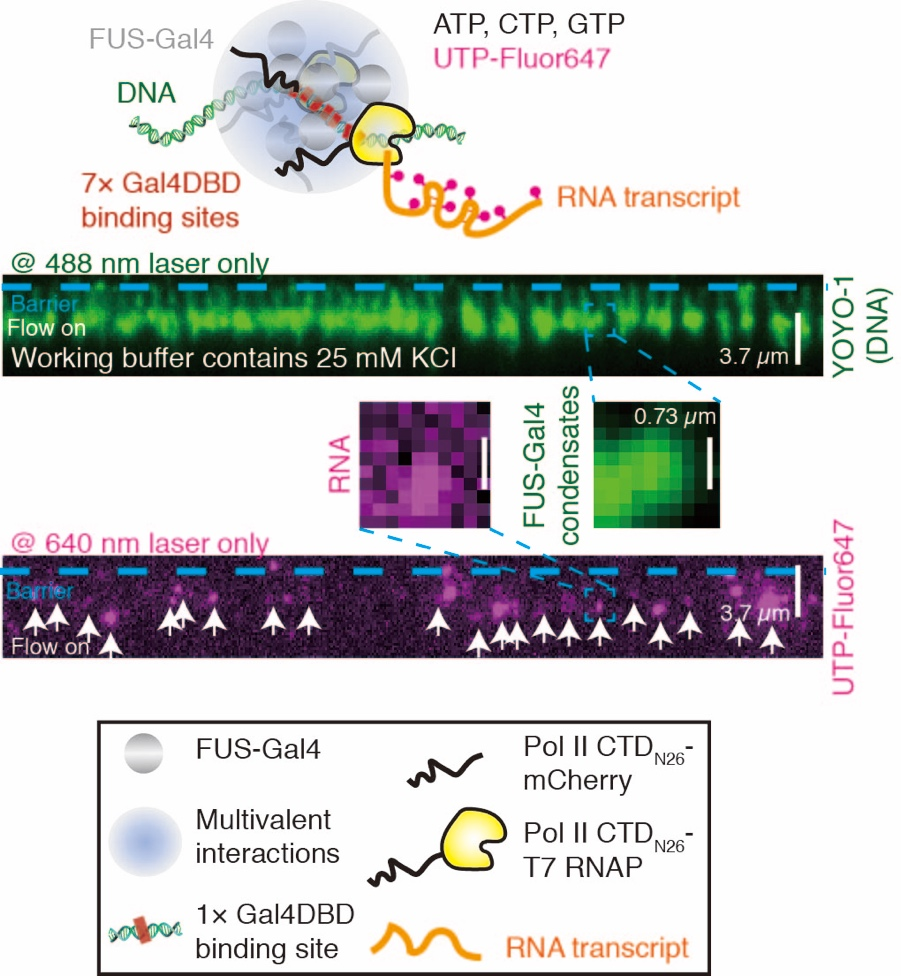
图1. DNA帘幕中依赖于FUS-Gal4融合蛋白聚集体的体外转录系统。
除此之外,作者还通过不同的实验设计,在DNA帘幕上看到了融合蛋白寻找靶标位点并在含有多乘靶标位点的区域成核并聚集成液滴的过程,并测得了融合蛋白在发生聚集后动力学性质的变化,以及靶标序列数目对融合蛋白相分离强度影响的差异,并提出了DNA序列对相分离液滴形成强度的阈值理论,这些结论可以对相关癌症的治疗提供可能的帮助。
总结一下,本课题利用体外单分子技术系统地研究了FET融合蛋白在特异性靶标位点形成相分离聚集促进下游基因转录的分子机制,并用该转录系统进一步证明DNA靶标序列的数量可以对转录水平起到调控作用(见图2)。我们探索出的多乘序列在这一转录调控过程中的重要性可以在相关癌症的治疗上提供帮助。
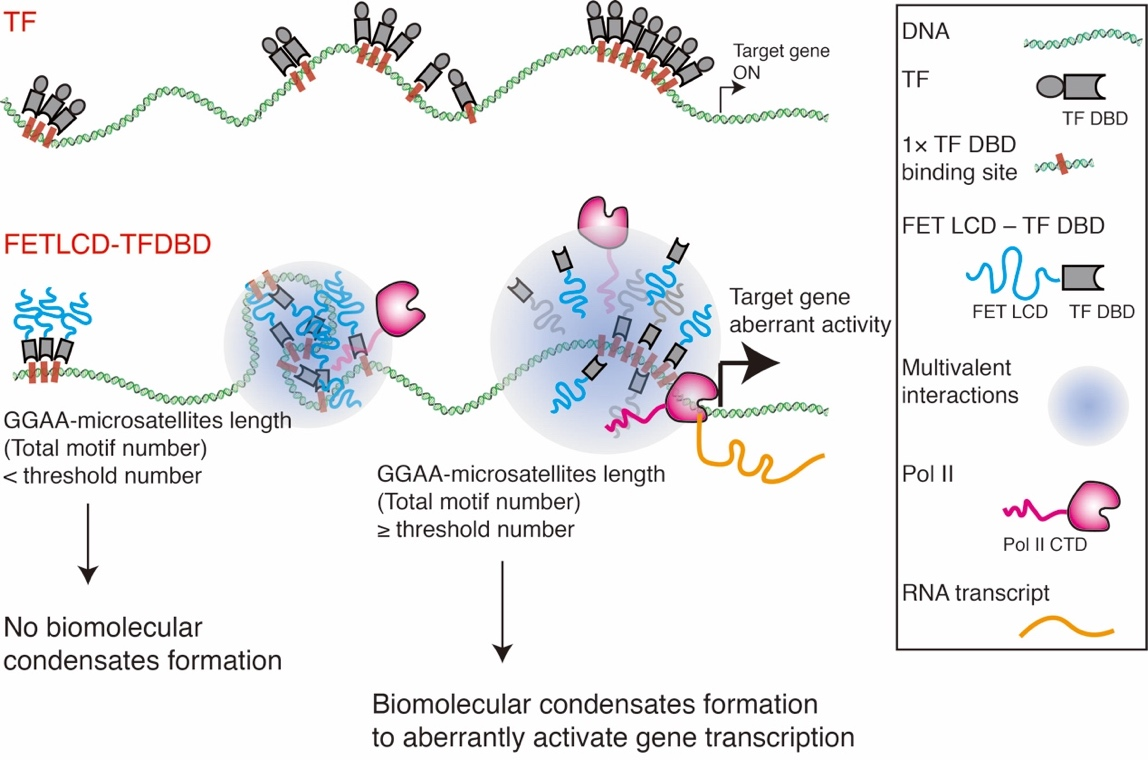
图2. FET融合蛋白在特异性靶标位点形成相分离聚集促进下游基因转录的模型。
北京大学前沿交叉学科研究院定量生物学中心齐志研究员、清华大学生命学院李丕龙研究员以及格拉斯哥大学黄旭研究员为本文的共同通讯作者。北京大学前沿交叉学科研究院生命科学联合中心2016级博士生左琳彧为本文第一作者。清华大学生命学院张冠伟、格拉斯哥大学博士Matthew Massett为本研究做出重要贡献,同时也感谢北京大学前沿交叉学科研究院定量生物学中心2018级博士生程军、生命科学联合中心2017级博士生郭梓聪、清华大学生命学院王亮博士等同学提供的大力帮助。该研究得到了国家自然科学基金委面上项目、北大-清华生命科学联合中心、清华大学高精尖结构中心、以及国家基金委和英国皇家学院共同赞助的国际合作项目的资助。
原文链接:https://www.nature.com/articles/s41467-021-21690-7
参考文献
1 Kim, S. & Shendure, J. Mechanisms of Interplay between Transcription Factors and the 3D Genome. Mol Cell 76, 306-319, doi:10.1016/j.molcel.2019.08.010 (2019).
2 Banani, S. F., Lee, H. O., Hyman, A. A. & Rosen, M. K. Biomolecular condensates: organizers of cellular biochemistry. Nature Reviews Molecular Cell Biology 18, 285-298, doi:10.1038/nrm.2017.7 (2017).
3 Sizemore, G. M., Pitarresi, J. R., Balakrishnan, S. & Ostrowski, M. C. The ETS family of oncogenic transcription factors in solid tumours. Nat Rev Cancer 17, 337-351, doi:10.1038/nrc.2017.20 (2017).
4 Chong, S. et al. Imaging dynamic and selective low-complexity domain interactions that control gene transcription. Science 361, doi:10.1126/science.aar2555 (2018).
5 Zhao, Y. L., Jiang, Y. Z. & Qi, Z. Visualizing biological reaction intermediates with DNA curtains. J. Phys. D-Appl. Phys. 50, 16, doi:10.1088/1361-6463/aa59cf (2017).