免疫耐受是癌症的一个基本特征。尽管目前已发现多种促进免疫逃逸的机制,但调控该过程的转录程序仍不明确。近日,北京大学定量生物学中心曾泽贤课题组与清华大学潘登合作(共同通讯)在Cancer Research在线发表题为“ZNF296 Drives Immune Evasion in Epithelial Cancers by Repressing Immune Stimulatory Genes” 的研究论文。该研究通过在全基因组范围内对接受自然杀伤(NK)细胞杀伤的人源癌细胞进行CRISPR激活筛选,发现上皮性肿瘤中高表达的转录因子ZNF296是肿瘤抵抗NK细胞及细胞毒性T淋巴细胞(CTL)介导的免疫应答的关键驱动因子。在小鼠模型中,抑制ZNF296可显著增强NK细胞和T细胞介导的抗肿瘤免疫,明显减少转移灶并促进免疫细胞向肿瘤微环境的浸润。在机制层面,ZNF296强烈抑制干扰素刺激基因及对NK与T细胞毒性至关重要的免疫刺激配体的转录。在分子水平上,ZNF296直接与NuRD染色质重塑及去乙酰化复合体相互作用,并将其募集至靶基因启动子区域以抑制基因表达。值得注意的是,使用低剂量罗米地辛(一种靶向NuRD复合体核心组分HDAC1的FDA批准抑制剂)处理,可有效恢复高表达ZNF296的癌细胞中NK细胞与T细胞介导的杀伤作用。综上,这些结果确立了ZNF296作为免疫逃逸的关键调控因子,驱动肿瘤对NK及T细胞介导的抗肿瘤免疫产生耐受,同时提示其可作为克服上皮性肿瘤免疫耐受的潜在治疗靶点。
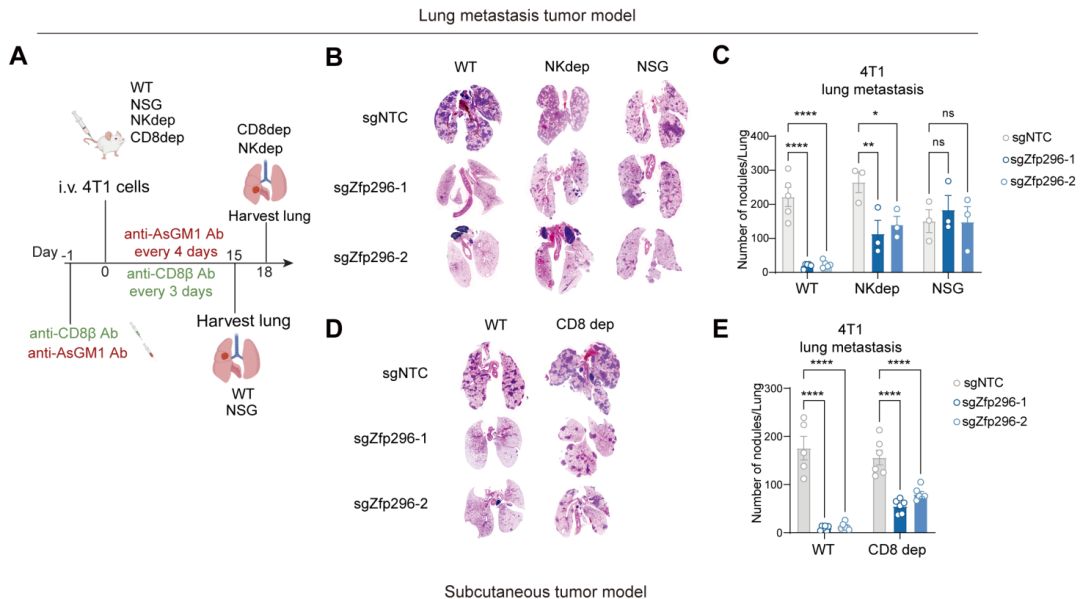
图: 抑制Zfp296抑制肿瘤生长,增强抗肿瘤免疫响应
肿瘤免疫逃逸是癌症进展与转移的根本驱动因素。阐明肿瘤逃避免疫监视的机制对于提高癌症免疫疗法的疗效至关重要。细胞毒性T淋巴细胞(CTL)与自然杀伤(NK)细胞是免疫监视的核心组分,作为一线防御力量通过直接杀伤肿瘤细胞并协调更广泛的免疫应答发挥作用。揭示破坏这些免疫细胞的肿瘤内在抵抗机制,是癌症免疫学领域的重要研究方向。随着CRISPR基因筛选等技术的进展,人们对肿瘤逃逸NK细胞与T细胞介导的免疫应答的分子通路有了更深入的认识。例如,通过全基因组CRISPR筛选,本团队及其他研究组已鉴定出多个驱动肿瘤逃避T细胞杀伤作用的内在抵抗机制。互补性研究则利用NK细胞共培养系统,揭示了肿瘤抵抗NK细胞介导杀伤的机制基础。这些研究证实,NK细胞活化配体(如B7-H6)的下调与抑制性配体(包括HLA-E)的上调是免疫逃逸的关键因素。此外,通过CRISPR筛选发现的CHMP2A基因,可通过增强MICA/B和TRAIL的胞外囊泡分泌来抑制NK细胞功能,从而促进肿瘤对NK细胞的抵抗。这些发现共同揭示了肿瘤采用多样化且复杂的策略实现免疫逃逸,并突显了深入探索这些通路以开发新型治疗策略的重要性。在癌症进展过程中,肿瘤会发生动态转录重编程,这一过程在免疫逃逸中起关键作用。转录因子(TF)作为基因表达的核心调控因子,通过调控特定转录程序来协调肿瘤免疫逃逸。例如,转录因子FOXA1可抑制STAT2活性,导致干扰素应答基因下调并引发继发免疫逃逸。值得注意的是,上皮-间质转化(EMT)转录状态与对NK细胞介导杀伤的敏感性密切相关:具有上皮样特征的肿瘤通常对NK细胞介导的细胞毒性具有抵抗性。这些研究揭示了转录程序在决定肿瘤对免疫介导杀伤敏感性中的核心作用。
ZNF296是一种锌指蛋白,在胚胎发育与表观遗传调控中发挥重要作用。在胚胎干细胞(ESC)中,ZNF296对于维持全局表观遗传状态、降低染色质可及性及抑制H3K9甲基化至关重要。近期研究也提示ZNF296参与肿瘤进展:其在急性髓系白血病(AML)与急性淋巴细胞白血病(ALL)中过表达,并在结肠癌小鼠模型的肿瘤区域呈现表达上调。尽管这些研究表明ZNF296的异位表达与肿瘤进展存在关联,但其在癌症发生发展中的具体功能作用与机制通路仍不明确。本研究首次发现肿瘤内在表达的ZNF296在调控抗肿瘤免疫中起关键作用。
原文链接:https://doi.org/10.1158/0008-5472.CAN-25-0153