生物大分子凝聚物是真核细胞中常见的无膜细胞结构,通常由蛋白、核酸等分子之间的多价相互作用引发的相分离所驱动形成,能够通过影响细胞内部的区室化来调节基因表达、胞内信号转导等多种重要的细胞生命活动1。这些凝聚物通常具有液态样的性质,在显微镜下表现为球型或液滴型的形貌。有趣的是,近期有多篇工作观察到一些细胞内或体外重建的核酸-蛋白共凝聚物会呈现出不规则的“珍珠链”型形貌2-4。不同的形貌与凝聚物的生物学功能密切相关,但调控这些凝聚物产生形貌转变的分子机制仍不完全清楚。此外,凝聚物的形貌转变与其材料性质转变之间的关系是什么?这两种转变如何体现在多组分相分离的相图上?不同形貌凝聚物的生长形成过程又有何差异?
近日,北京大学前沿交叉学科研究院定量生物学中心齐志课题组与南京大学物理学院李文飞课题组、清华大学生命学院陈春来课题组合作在Structure在线发表了题为“Deciphering the molecular mechanism underlying morphology transition in two-component DNA-protein cophase separation”的论文以探讨上述问题。

为了降低实验体系的复杂度,研究者使用一类特殊的核酸-蛋白共凝聚物作为模式体系:单独的DNA或单独的蛋白均不能形成凝聚物,只有当两种组分混合才能形成凝聚物,这种共凝聚物也被称为DNA-蛋白互作共凝聚物(DNA-protein interactive co-condensate, DPIC)。由于p53蛋白具有四聚化结构、两种不同的DNA结合模式、以及生理条件下自身不能单独形成凝聚物等特点5,6,作者在体外纯化了p53蛋白,并发现转录激活结构域(Transactivation domain, TAD)缺失的p53截短体能够与不含p53结合位点的随机序列DNA(Random DNA)通过静电相互作用产生DPIC。这些DPIC通过相互融合而长大,但其融合速度慢,并且融合后DPIC内部的蛋白和DNA难以发生物质交换。此外,荧光淬灭恢复实验(Fluorescence recovery after photobleaching, FRAP)还观察到蛋白荧光信号可随时间缓慢恢复,而DNA荧光信号基本难以恢复(图1)。这些现象都说明DPIC具有较特殊的内部结构与材料性质。
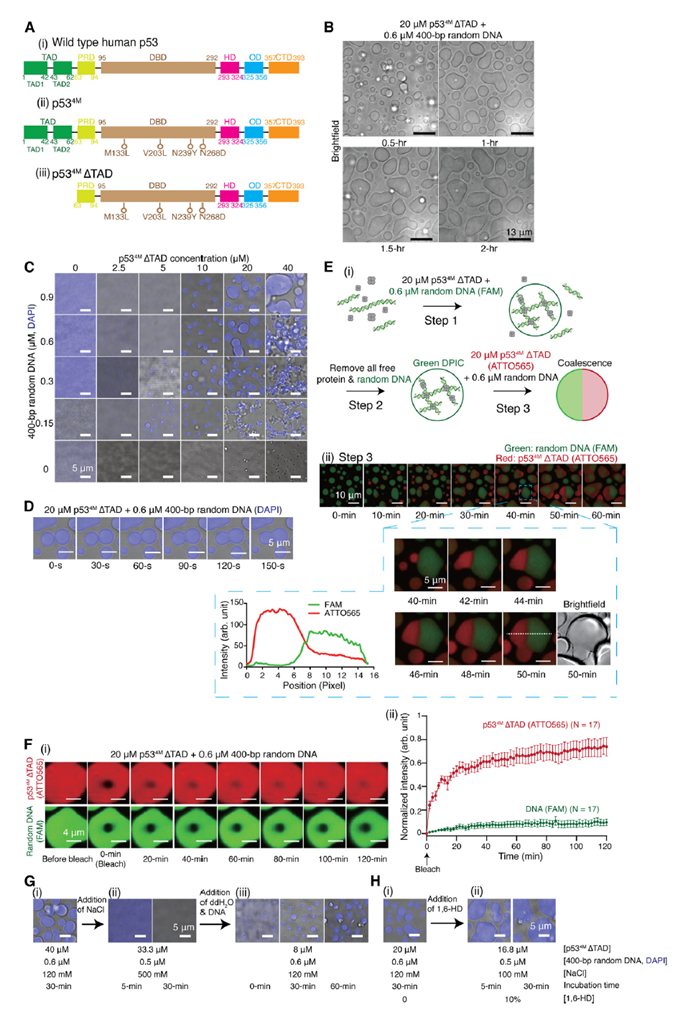
图1. DNA-p53 DPIC的主要性质表征。
作者使用了粗粒化分子动力学模拟分析了DPIC内部的DNA和p53的相互作用特征,发现DPIC是由蛋白和DNA相互桥联所形成的网络状结构凝聚物:一个蛋白可同时结合多条双链DNA,且一条双链DNA能同时结合多个蛋白(图2)。基于这一结构,作者认为DNA上蛋白的桥联数量与蛋白-DNA桥联的稳定性均会影响到DPIC的性质,这两种因素被统称为表观分子间相互作用强度εapp(Apparent inter-molecule interaction strengths)。
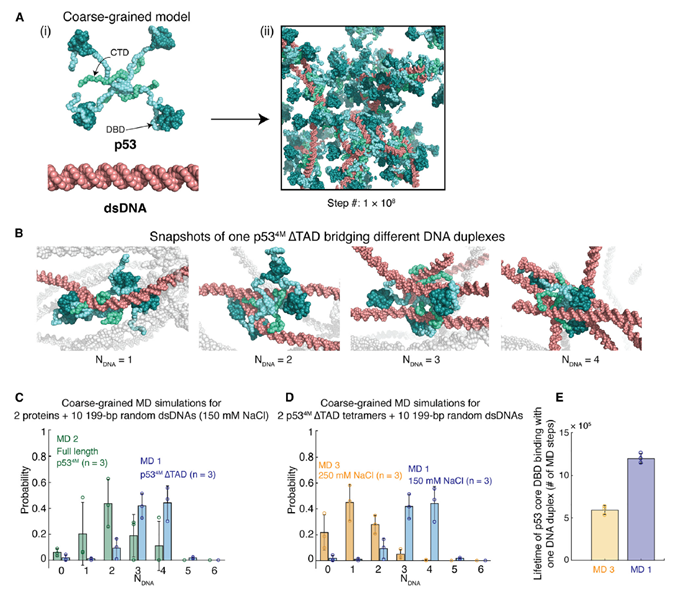
图2. 粗粒化分子动力学模拟得到的DNA-蛋白桥联结构及调控因素。
进一步实验发现,提高DPIC体系中蛋白与DNA的浓度比例(即增加桥联数量),或向DNA引入能与p53产生较高亲和力的p21序列(即增强桥联稳定性),均能导致珍珠链型形貌的DPIC出现(图3),说明凝聚物的形貌转变与εapp高度相关。那么形貌的转变能否直接对应DPIC的材料性质转变呢?或者说,这两种转变是同时发生的吗?作者使用原子力显微镜力谱(Atomic force microscopy-based force spectroscopy, AFM-FS)对几种液滴型DPIC的力学性质进行测量,发现即便尚未发生形貌上的转变,增强εapp足以引发DPIC从黏弹性流体向粘弹性固体的材料性质转变。将DPIC的形貌与材料性质信息画在DNA-蛋白的双组分相图上,可见伴随εapp增加,DPIC的材料性质转变会先于形貌转变发生(图4)。
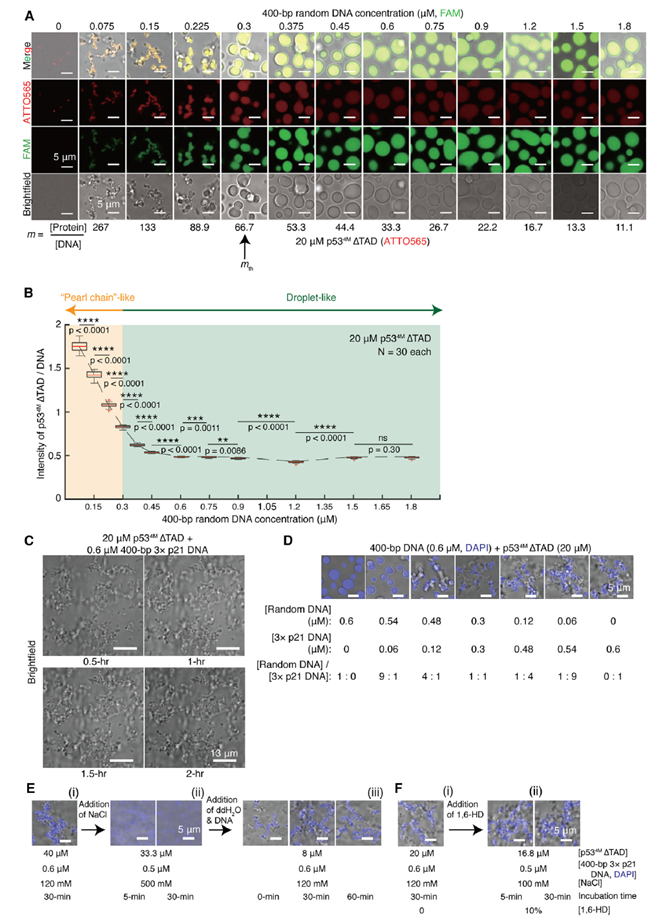
图3. 提高体系中的εapp可以导致DPIC产生珍珠链型形貌。
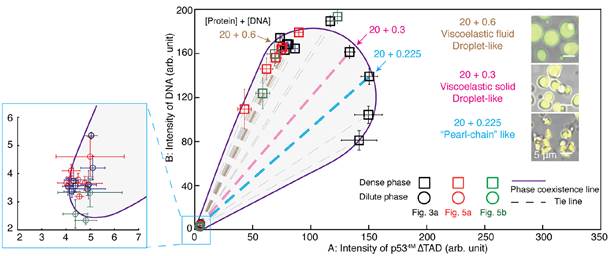
图4. 固定孵育时间下的DNA-蛋白的双组分相图
为了解液滴型和珍珠链型DPIC在相分离的早期阶段是否就已存在差异,作者使用双色荧光互相关光谱(Dual-color fluorescence cross-correlation spectroscopy, dcFCCS)对相分离早期形成的纳米尺度的DPIC进行测量,发现两种DPIC在相分离早期阶段具有相近的水合半径,随着凝聚物的继续生长,两者的水合半径会出现显著差异(图5)。
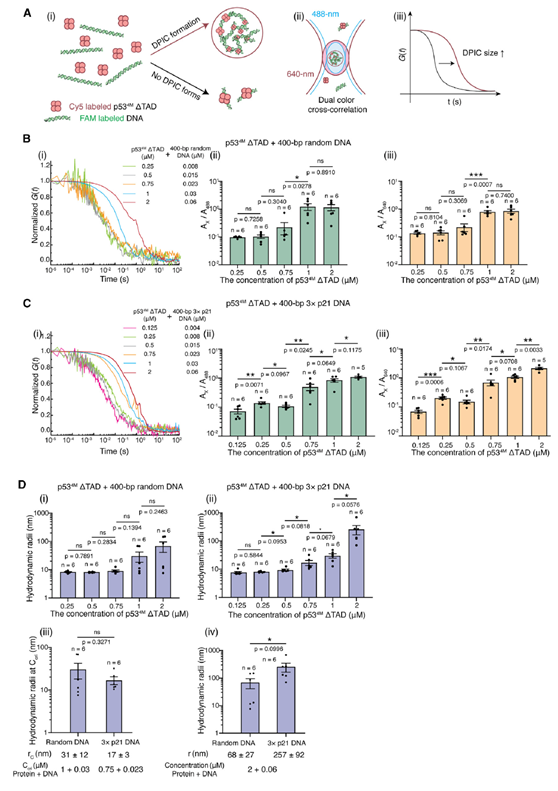
图5. dcFCCS实验观察相分离早期状态下的DPIC
结合上述的AFM-FS、dcFCCS的实验结果和目前较为成熟的相分离成核生长理论7,作者提出DPIC的生长动力学模型:DPIC的形成可以分两个阶段,在第一阶段,DNA与蛋白之间发生相互桥联并形成纳米微团,由于不同实验条件下εapp不同,因此这些微团会具有不同的粘弹性特性,表现出不同的弛豫时间。在第二阶段,微团开始相互融合。如果微团的弛豫时间较短,其融合产物可以很好地完成弛豫并形成液滴型形貌DPIC;相反,如果弛豫时间很长,那么在观测时间尺度内DPIC无法完成弛豫,从而产生珍珠链型形貌。为此,作者使用二维非格点模型(2D off-lattice model)、黏弹性相分离(Viscoelastic phase separation model, VPS)模型确认了弛豫时间对凝聚物形貌的重要性,并在实验上观察到延长观测时间,珍珠链型DPIC形貌逐渐变化、圆度提高的现象。这些实验结果支持前述生长动力学模型的合理性。
综上所述,该课题使用双链DNA和人转录因子p53蛋白为模式研究体系,发现增强DNA-蛋白相互作用强度能够导致共凝聚物出现从黏弹性流体向黏弹性固体的材料性质转变和从液滴型向珍珠链型的形貌转变,且材料性质转变先于形貌转变。该课题还发现在相分离的早期阶段,液滴型和珍珠链型共凝聚物均会形成尺寸相近的纳米结构。由于DNA-蛋白相互作用强度不同,这些纳米结构及其融合产物具有不同的弛豫时间,这对在微米尺度下共凝聚物的最终形貌起到了决定性作用(图6)。该研究为理解并进一步调控细胞内复杂的多组分生物大分子凝聚物提供了重要的实验和理论基础,有望为相关疾病的干预提供新的思路和策略。
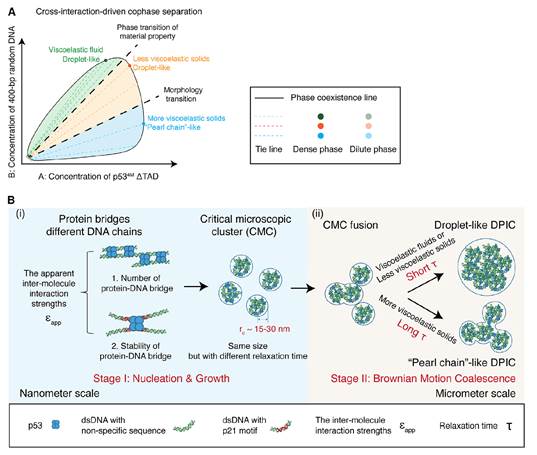
图6. DNA-蛋白共凝聚物的双组分相图及其生长与形貌形成机制示意图
北京大学前沿交叉学科研究院定量生物学中心齐志副教授、南京大学物理学院李文飞教授、清华大学生命学院陈春来副教授为本文的共同通讯作者。北京大学前沿交叉学科研究院定量生物学中心汤超院士、林杰研究员为本文的共同作者。北京大学前沿交叉学科研究院生命科学联合中心毕业生李承博士(现北京大学前沿交叉学科研究院生命科学联合中心博士后)、中国科学院大学温州研究院边运强副研究员、清华大学生命学院博士生汤依婷为本文共同第一作者。北京大学前沿交叉学科研究院生命科学联合中心博士生孟令羽、毕业生尹佩佩博士(现北京师范大学生命科学学院)、北京大学元培学院本科毕业生洪烨(现清华大学生命学院博士生)、北京大学前沿交叉学科研究院定量生物学中心毕业生程军博士、生命科学联合中心博士生李雨辰参与此项工作。该研究得到如下资助:National Natural Science Foundation of China (Grant No. T2225009 (Z.Q.), T2321001, 31670762 (Z.Q.), 32088101, 11974173 (W.L.), 22425701, 21922704, 22061160466, and 22277063 (C.C.)). The grant of Wenzhou Institute, University of Chinese Academy of Sciences (WIUCASQD2022036 (Y.B.) and WIUCASQD2021010) (W.L.))。
文章链接:https://www.cell.com/structure/abstract/S0969-2126(24)00461-1
北京大学前沿交叉学科研究院定量生物学中心的齐志课题组聚焦研发新型多维度、跨尺度单分子技术,并把非平衡态物理学融入交叉研究,解析生物大分子动态聚集体的分子机理:
1. 转录调控中的核酸-蛋白共凝聚物的分子机制;
2. DNA修复中的单链DNA-RPA复合物的分子机制;
3. RNA biology中的RNA-蛋白共凝聚物的分子机制;
欢迎已获得或短期内可获得物理、化学、生物、或工程等相关专业博士学位的有志科研之士申请博士后及科研助理职位。按照北京大学相关规定执行,提供具有国际竞争力的待遇条件,优秀者推荐申请“北大博雅博士后基金”,具体待遇面议。申请者请将个人简历投递zhiqi7@pku.edu.cn(应聘理由请注明“博士后申请+姓名”)。本招聘长期有效。
导师信息及相关个人页面:http://cqb.pku.edu.cn/qizhi/ (联系方式:zhiqi7@pku.edu.cn)。
南京大学物理学院李文飞课题组聚焦融合物理原理与人工智能算法的生物大分子计算工具开发、纳米到微米尺度生物分子体系结构/动力学模拟、预测与设计。欢迎对物理学与生命科学交叉研究感兴趣的同学加入课题组攻读博士学位或开展博士后合作研究 (联系方式:wfli@nju.edu.cn)。
清华大学生命学院陈春来课题组侧重发展并利用单分子荧光技术,精准测量生物大分子的动态行为和规律,从而在分子水平阐释其功能执行和调控机制,并在此基础上进行分子的改造和功能优化。欢迎感兴趣的同学加入课题组攻读博士学位或开展博士后合作研究 (联系方式:chunlai@mail.tsinghua.edu.cn)。
导师信息:https://life.tsinghua.edu.cn/info/1033/2453.htm
参考文献
1. Banani, S.F., Lee, H.O., Hyman, A.A., and Rosen, M.K. (2017). Biomolecular condensates: organizers of cellular biochemistry. Nature Reviews Molecular Cell Biology 18, 285-298. 10.1038/nrm.2017.7.
2. Ma, W., Zhen, G., Xie, W., and Mayr, C. (2021). In vivo reconstitution finds multivalent RNA–RNA interactions as drivers of mesh-like condensates. eLife 10. 10.7554/eLife.64252.
3. Gibson, B.A., Doolittle, L.K., Schneider, M.W.G., Jensen, L.E., Gamarra, N., Henry, L., Gerlich, D.W., Redding, S., and Rosen, M.K. (2019). Organization of chromatin by intrinsic and regulated phase separation. Cell 179, 470-484. 10.1016/j.cell.2019.08.037.
4. Strickfaden, H., Tolsma, T.O., Sharma, A., Underhill, D.A., Hansen, J.C., and Hendzel, M.J. (2020). Condensed chromatin behaves like a solid on the mesoscale in vitro and in living cells. Cell 183, 1772-1784. 10.1016/j.cell.2020.11.027.
5. Joerger, A.C., and Fersht, A.R. (2008). Structural biology of the tumor suppressor p53. Annu Rev Biochem 77, 557-582. 10.1146/annurev.biochem.77.060806.091238.
6. Kamagata, K., Kanbayashi, S., Honda, M., Itoh, Y., Takahashi, H., Kameda, T., Nagatsugi, F., and Takahashi, S. (2020). Liquid-like droplet formation by tumor suppressor p53 induced by multivalent electrostatic interactions between two disordered domains. Sci Rep 10, 580. 10.1038/s41598-020-57521-w.
7. Berry, J., Brangwynne, C.P., and Haataja, M. (2018). Physical principles of intracellular organization via active and passive phase transitions. Rep Prog Phys 81, 046601. 10.1088/1361-6633/aaa61e.