2021年6月11日,北京大学前沿交叉学科研究院定量生物学中心刘燕燕博士等在eLife期刊发表了题为“A putative structural mechanism underlying the antithetic effect of homologous RND1 and RhoD GTPases in mammalian plexin regulation”的研究论文。该研究通过分子动力学模拟揭示了两个相似的GTP酶RND1和RhoD对哺乳类动物蛋白plexin活性具有相反调控作用的动态结构机制,即由于二者C末端的长度和带正电残基的不同,导致二者与带有负电的细胞膜相互作用不同,使得RND1稳固了plexin二聚化的界面从而成为plexin的激活剂;而RhoD则破坏了plexin二聚化的界面,导致plexin失活。
Plexin是哺乳动物神经引导分子Semaphorin的受体。Plexin的结构除了胞外区和跨膜区以外,还包括胞内区的GTP酶激活区域(GAP)、与Rho家族的调控GTP酶结合区域(RBD)和一个存在于GAP区与跨膜区之间的二聚化helix (图1A)。之前研究表明,plexin信号传导的重要先决条件是通过二聚化helix之间的界面发生二聚(图1B),并且需要在RBD区域结合Rho家族的调控GTP酶。作为Rho家族的两个同源性非常密切的GTP酶,RND1和RhoD能够以非常相似的模式和亲和力与RBD发生结合[1, 2],却对二聚体plexin的活性有着截然不同的两种调控结果,RND1可以激活plexin的信号传导,RhoD则抑制了plexin的信号传导[3]。然而,关于为什么RhoD和RND1对plexin信号传导具有相反的调控作用,之前尚不清晰。
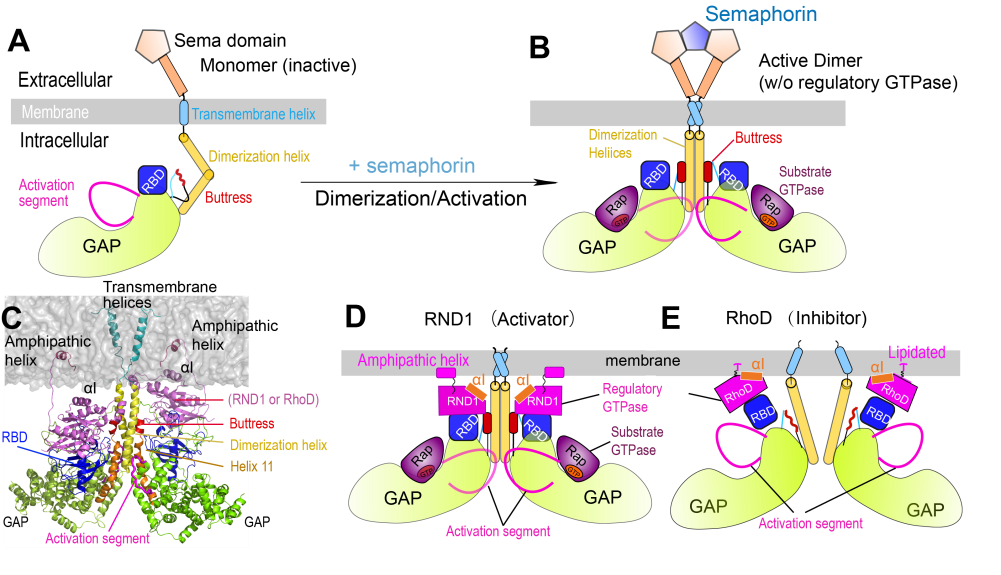
图1. Plexin的结构组成(A)、二聚化机制(B)、模拟体系构建(C)和提出的结构机制假说(D-E)
为了探究RND1和RhoD对plexin活性调控截然相反的结构机制,美国德克萨斯大学西南医学中心张学武课题组解析了RhoD/plexin B2-RBD的晶体结构,证明了RhoD具有其它Rho家族的调控GTP酶与RBD相似的结合模式。刘燕燕等根据已解析的晶体结构信息,结合同源模建技术,构建了含有膜、plexin二聚体(去除胞外区)、与RBD结合的GTPase蛋白RND1/RhoD的体系模型(图1C)。此模型的构建充分依据晶体结构中获得的已知信息,比如RBD与RND1/RhoD的复合体结构是保守的,plexin二聚体与膜的相对位置理论上是对称的等。因此,该研究中构建的初始结构对于分别结合RND1和RhoD的体系而言,是非常相似的。然后,作者利用分子动力学模拟考察了所构建的体系结构随着模拟时间的一系列动态变化,分析结果后对三个界面间的接触进行了着重研究:(1) RND1/RhoD与细胞膜间的界面接触(图2A, 2B&2C);(2) RND1/RhoD与RBD间的界面接触(图2D);(3) RBD与GAP区之间的界面接触(图2E)。
分子动力学模拟轨迹显示,RhoD在1微秒的模拟时长内逐渐向膜贴近并最终与膜有稳定的接触,而RND1则一直与膜保持原有的空隙。分析结果显示,RhoD与膜的接触面积和接触残基的数量随模拟时间都有所增加,而RND1与细胞膜的接触面积和接触残基随时间均没有明显变化 (图2A&2B)。作者分析发现在RhoD中与膜发生接触的残基大多是带正电的,而在RND1对应位置的残基则是不带电的(图2C)。由于磷脂膜模型中包含带负电荷的POPS和PIP2等,静电吸引作用的不同被认为是二者与膜互作不同的原因。
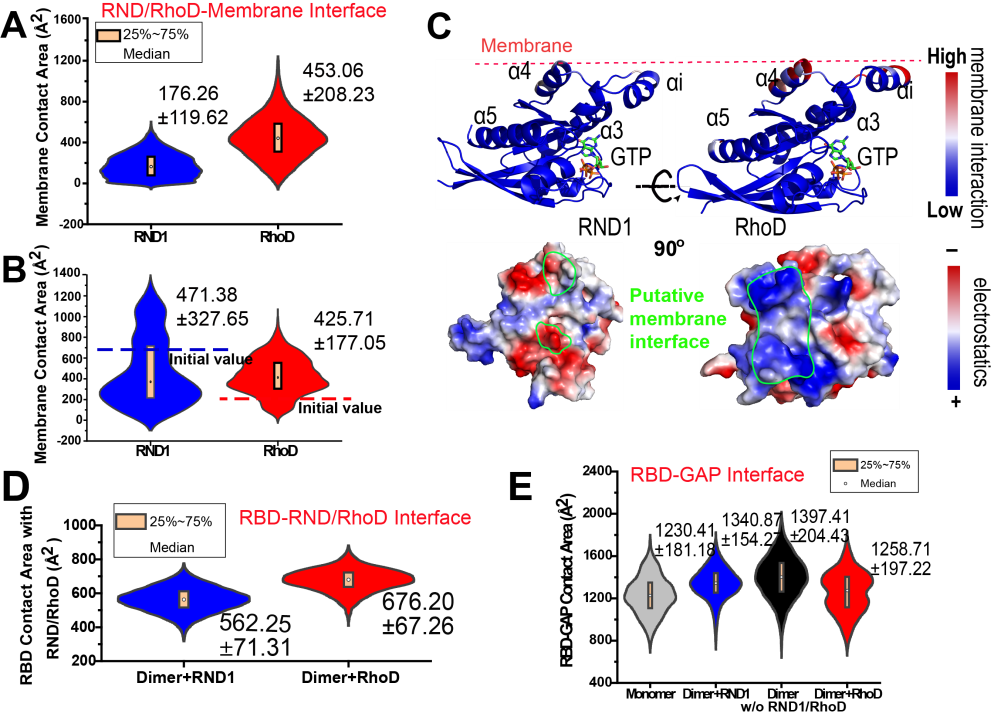
图2. 界面接触面积及RND1/RhoD的表面静电势和残基带电情况
进一步的界面接触面积分析表明(图2D),RhoD/RND1与RBD的结合相对稳定。因而,RhoD和RND1与细胞膜静电吸引结合的能力不同,会导致RhoD/RND1-RBD作为一个整体与膜的靠近程度和稳定距离不同,RBD与GAP区之间的接触面积也会随之变化(图2E)。这会进一步导致与RBD两端相连接的buttress segment发生不同的构象变化,并影响其所支撑的二聚化helix的结构稳定性,从而影响plexin的活性 (图3)。基于上述 “牵一发而动全身”的模拟现象,作者提出了可以解释RND1和RhoD对plexin活性调控作用相反的结构机制的假说模型(图1D和 1E)。这一机制的提出可为其它类似的信号传导膜蛋白的作用机制提供借鉴意义。
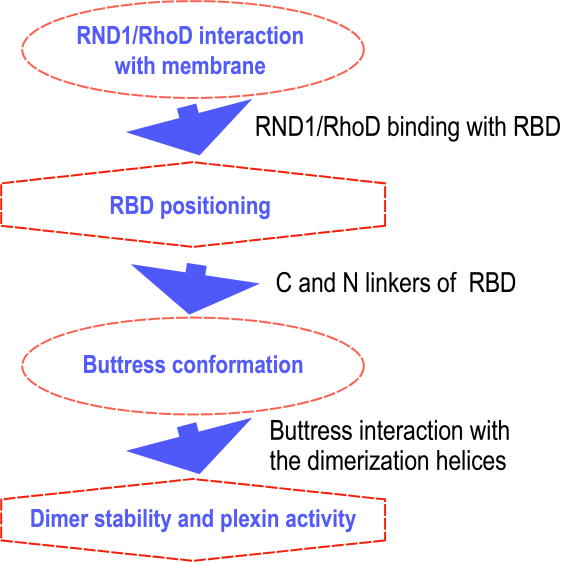
图3. RND1/RhoD对plexin二聚体活性调控的机制概要
北京大学前沿交叉学科研究院定量生物学中心博士后刘燕燕为本论文的第一作者。前D. E. Shaw资深研究员、Antidote Health Foundation创始人单一兵教授,北京大学宋晨研究员,以及美国德克萨斯大学西南医学中心张学武教授为本论文的共同通讯作者。北京计算科学研究中心的柯谱博士参与了该项研究模型构建工作并作出重要贡献;美国德克萨斯大学西南医学中心的KUO Yi-chun、WANG Yuxiao博士参与了该项研究的晶体结构解析工作并作出重要贡献。本工作得到北京大学博雅博士后项目、国家自然科学基金以及北大-清华生命科学联合中心等方面的资助和支持。
本稿作者:刘燕燕
原文链接:https://elifesciences.org/articles/64304
参考文献:
1. Bell, C.H., et al., A Dual Binding Mode for RhoGTPases in Plexin Signalling. Plos Biology, 2011. 9(8): p. e1001134.
2. Fansa, E.K., et al., Interaction characteristics of Plexin-B1 with Rho family proteins. Biochemical and Biophysical Research Communications, 2013. 434(4): p. 785-790.
3. Zanata, S.M., et al., Antagonistic effects of Rnd1 and RhoD GTPases regulate receptor activity in semaphorin 3A-induced cytoskeletal collapse. Journal of Neuroscience, 2002. 22(2): p. 471-477.