天然无序蛋白质(Intrinsically Disordered Proteins)是近年来发现的一类特殊的蛋白质,它们在天然条件下没有确定的三维结构,却具有正常的生物学功能,广泛参与信号传递、DNA 转录和细胞分裂等重要过程。天然无序蛋白质的发现不但是对传统的蛋白质“序列-结构-功能”范式的挑战与补充,而且可以对很多疾病的治疗提供新的思路。
北京大学定量生物学中心刘志荣副教授课题组利用分子模拟的方法在天然无序蛋白质体系上作出了一系列的工作:揭示了天然无序蛋白质动力学优势的微观原因【J. Mol. Biol. 393, 1143 (2009),被Faculty of 1000 Biology所highlight】;提出了“动力学缓冲效应”的概念【Proteins 78, 3251 (2010);PLoS ONE 5, 15375 (2010)】;揭示天然无序蛋白质具有更好的焓-熵补偿效应【Int. J. Mol. Sci. 12, 1410 (2011); Chem. Eur. J. 19, 4462 (2013)】;揭示了几种天然无序蛋白质预测算法之间的内在关联【Biophys. J. 104, 488 (2013)】。最近,他们与同单位的来鲁华教授课题组合作在研究中揭示了天然无序蛋白质与配体小分子全新的“云”作用模式。
天然无序蛋白质是具有重大发展潜力的药物靶标。由于天然无序蛋白质缺乏单一结构,在实验上很难对其特征进行精确表征。为了研究天然无序蛋白质与配体小分子的作用模式,该团队利用计算机分子模拟的方法研究了原癌蛋白c-Myc与其抑制剂配体小分子的相互作用。结果显示,原癌蛋白c-Myc在结合配体后仍然保持无序状态。与传统的蛋白质-配体结合所形成稳定的口袋结构不同,配体小分子以一定的概率结合在原癌蛋白c-Myc上的多个离散位点。为了刻画这种全新的结合性质,该研究团队提出了“配体云”的概念,认为天然无序蛋白质与配体的作用是以“配体云环绕着蛋白质云”(见下图)的方式进行的。配体云的概念彰显了天然无序蛋白质在结合过程中的特殊的选择性与特异性。
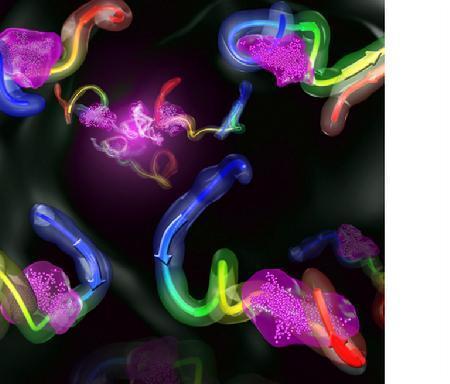
插图含义介绍:配体小分子象“云”一样(图中紫色点泡状结构)
以一定的概率结合在原癌蛋白c-Myc序列上的多个离散部位。
该研究成果近期以封面文章的形式发表在《公共科学图书馆·计算生物学》上:Fan Jin, Chen Yu, Luhuai Lai*, and Zhirong Liu* (2013) Ligand clouds around protein clouds: a scenario of ligand binding with intrinsically disordered proteins. PLoS Computational Biology 9 (10): e1003249/1-11. 论文第一作者为定量生物学中心直博生金凡(2013届毕业生,导师刘志荣),第二作者为化学学院直博生余辰(导师来鲁华)。
这些工作受到国家自然科学基金委员会、科技部和北京大学的资助。