世界卫生组织推测,到2050年,由抗生素和抗癌药物的耐药现象导致的死亡,会成为人类在未来生存的头号杀手。在临床实践中,病原体或者癌细胞获得性耐药突变的出现几乎是不可避免的,经过一段时间的使用后,药物会变得低效或者无效。例如,EGFR激酶靶向药是目前非小细胞肺癌患者一线治疗的标准药物,显著提升了患者的治疗效果和生存质量,但是由于耐药性的问题,使用第一代靶向药的中位靶向治疗时间为16个月。为解决耐药性问题,药物研发人员只能继续开发新一代的药物去对抗产生耐药突变的个体,而这一般需要大量的研发投入和若干年的时间,通常会滞后于耐药性的出现。2017年3月EGFR第三代靶向药奥希替尼在中国上市,随着奥希替尼一线及二线的广泛应用,奥希替尼耐药的问题日渐显著,由于第四代靶向药才刚进入I期临床,目前部分患者已经面临无药可用的局面。
为了加速抗耐药性药物的研发,来鲁华、裴剑锋团队开发了一种能提前预测耐药性突变的新策略,该策略基于靶标蛋白的三维结构和药物分子信息,进行潜在耐药突变的预测和发现,基于该策略有望能提前1-3年布局开发新一代抗耐药突变体的药物,为解决耐药性问题提供了新的思路。他们的策略包含了计算和实验的组合。计算部分(EVER算法)模拟突变体的进化过程,包括三个主要步骤:药物结合位点DNA序列进化,蛋白质结构建模和对接,评分体系的构建和选择。使用EGFR激酶靶向药(吉非替尼)和BCR-ABL激酶靶向药(伊马替尼,电影“我不是药神”中“格列宁”的原型药、尼罗替尼、达沙替尼和普纳替尼)作为案例研究,EVER成功预测到了多种临床中观察到的耐药性突变,且预测出的突变概率分布和临床数据基本一致。在计算中,EVER不仅考虑了激酶-药物结合,而且考虑了突变不能破坏或显著提高酶活性。
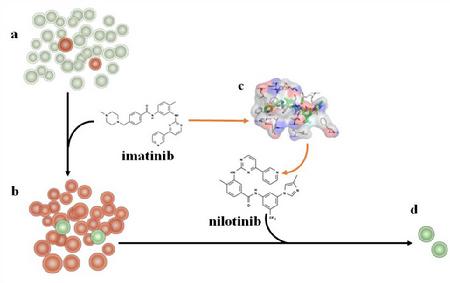
图1.靶向药物耐药突变预测新策略示意图。初始的癌细胞群体(a)中大部分为药物敏感细胞,少量为耐药细胞,经过一段时间的第一代药物临床治疗后,药物失效,癌细胞群体逐渐改变到状态(b);这时必须使用第二代药物进行治疗才能继续杀死癌细胞;经过一段时间的应用后,第二代药失效,需要第三代药,该过程不断重复,新一代药物的研发需要紧跟癌细胞耐药性的发展;而对最新一代上市药物产生耐药性的病人面临无药可用的困境。本工作所发展的抗耐药性药物研发新策略(c), 可以在药物耐药细胞出现的前1-3年进行新一代药物的前瞻性研发,从而加速抗耐药性药物研发的进程,为临床耐药性突变做好药物储备。
在对计算预测结果的体外实验验证中,进一步发现预测得到的突变类型均可以引起一定程度的结合能力的下降,但半数抑制浓度并不一定同比例改变。临床发生的耐药突变通常不会大幅度改变酶动力学常数,而未在临床中出现的突变体的酶活性往往有显著的改变,这说明激酶活性受到生物体严格调控;同时发现只有当半数抑制浓度超过一定阈值的情况下,才会产生临床耐药。基于以上结果,他们提出一种新的有效预测激酶药物抗性突变的策略:首先使用EVER算法预测可能的耐药突变体,然后用体外实验测定药物对所预测突变体的半数抑制浓度,如果半数抑制浓度的变化超出了药物的安全窗口,则该突变体具有很大的可能在未来的临床实践中出现,通过这个策略可以针对潜在的耐药性突变提前进行新一代药物的设计。
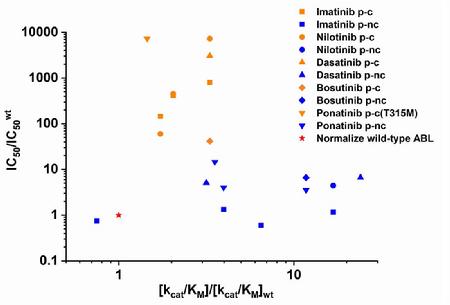
图2.与野生型相比,药物对临床中发生的耐药性突变体具有更高的半数抑制浓度,临床中发生的耐药性突变体通常不会大幅度改变其酶动力学常数;而药物对未在临床中出现的突变体的半数抑制浓度变化不大,且未在临床中出现的突变体的酶动力学常数一般相对野生型变化较大。临床中发生的耐药性突变体和未在临床中出现的突变体具有明显的分割区间。
该研究工作于1月9日发表在Communications Biology杂志上(https://www.nature.com/articles/s42003-019-0743-5)。PTN项目已毕业的2014级博士研究生刘金鑫为该文的第一作者,来鲁华教授和裴剑锋研究员为本文的通讯作者。论文工作得到了张伟林博士、徐优俊博士和CLS 2019级博士研究生邓博等人的帮助。该工作获得了国家自然科学基金、国家重点研发计划的资助和支持。