DNA代谢是生命体中最重要的生命活动,而单链DNA(ssDNA)是三大DNA代谢途径(DNA复制、重组、修复)中共同的关键中间产物。细胞能够通过调节组蛋白排列的松紧程度即染色质开放度来调控双链DNA的可及性(DNA accessibility),然而,人们对于单链DNA可及性的调控机制还知之甚少。RPA(Replication protein A)作为人体中最主要的单链DNA结合蛋白,在几乎所有的DNA代谢途径中都是不可或缺的。2013年发表在Cell杂志上的文章发现过量的DNA复制压力可以诱导细胞内RPA耗竭从而产生更多裸露的单链DNA,进而导致DNA双链断裂损伤1。因此,RPA的动态结合为单链DNA提供的保护作用对于维持基因组稳定性至关重要。然而,现有机制中亟待解决的一大问题是,RPA如何在既为单链DNA提供紧密保护、阻止核酸酶接触并切割单链DNA的同时,又保证下游通路的其它蛋白适时地接触并结合到单链DNA上发挥作用。比如,细胞的DNA复制过程中出现的单链DNA同样也是DNA修复通路中同源重组(Homologous recombination, HR)酶Rad51的底物,后者不适时的结合会导致基因组紊乱。
近日,北京大学定量生物学中心齐志实验室、来鲁华实验室,联合美国印第安纳大学牛恒尧实验室,在Nature Communications杂志发表题为ssDNA accessibility of Rad51 is regulated by orchestrating multiple RPA dynamics的文章,合作阐释了单链DNA结合蛋白RPA通过动态调整其DNA结合模式来调节单链DNA对Rad51的可及性的分子机制。

该研究选用真核生物酿酒酵母为模式体系,为了研究RPA的动态结合模式,作者发展了新型的体外单分子实验技术,即三步法低复杂度单链DNA帘幕(Three-step low-complexity ssDNA Curtains)技术,其中使用滚环复制(Rolling circle replication, RCR)制备的低复杂度长单链DNA作为底物,利用该技术,作者实时监测了GFP标记的RPA结合过程中单链DNA的延展长度和荧光强度的变化,并通过改变溶液盐浓度发现RPA的两种DNA结合模式具有不同的单链DNA延展长度,从而确立了长度分析作为区分RPA的两种DNA结合模式的指标(图1)。RPA由三个亚基组成,大亚基Rfa1上有DBD-A、DBD-B和DBD-C三个DNA结合结构域(DNA binding domain, DBD),第四个DBD-D位于Rfa2上,不同DBD之间通过柔性肽链相连接,每个DBD都能独立地从单链DNA上结合或解离,因此RPA在具有极高的单链DNA亲和力的同时也具有高度的动态性,此前报道RPA的两种稳定的DNA结合模式具有不同的核苷酸(nucleotide, nt)步长,第一种是A、B、C、D都参与的30-nt结合模式,第二种是A、B、C参与的20-nt结合模式。作者通过EMSA实验分析了一系列不同长度的短单链DNA底物与RPA的结合,并通过前文所述的单分子技术分析了RPA在长单链DNA底物上结合的动态过程,发现了RPA在单链DNA上空位较多时会优先采用30-nt结合模式,此前解析的晶体结构中表明该模式下DNA会被弯曲成“U”字形2,因此观测到的延展长度较短,RPA浓度的升高会诱导RPA以20-nt结合模式进一步填补单链DNA上裸露的空位,这种模式下单链DNA的延展长度相对较长。作者还发现削弱DBD-D结合的RPA突变体(RPA-Dminus)会加速向20-nt结合模式对应的长单链DNA构象的转变,进一步验证了这一结论。
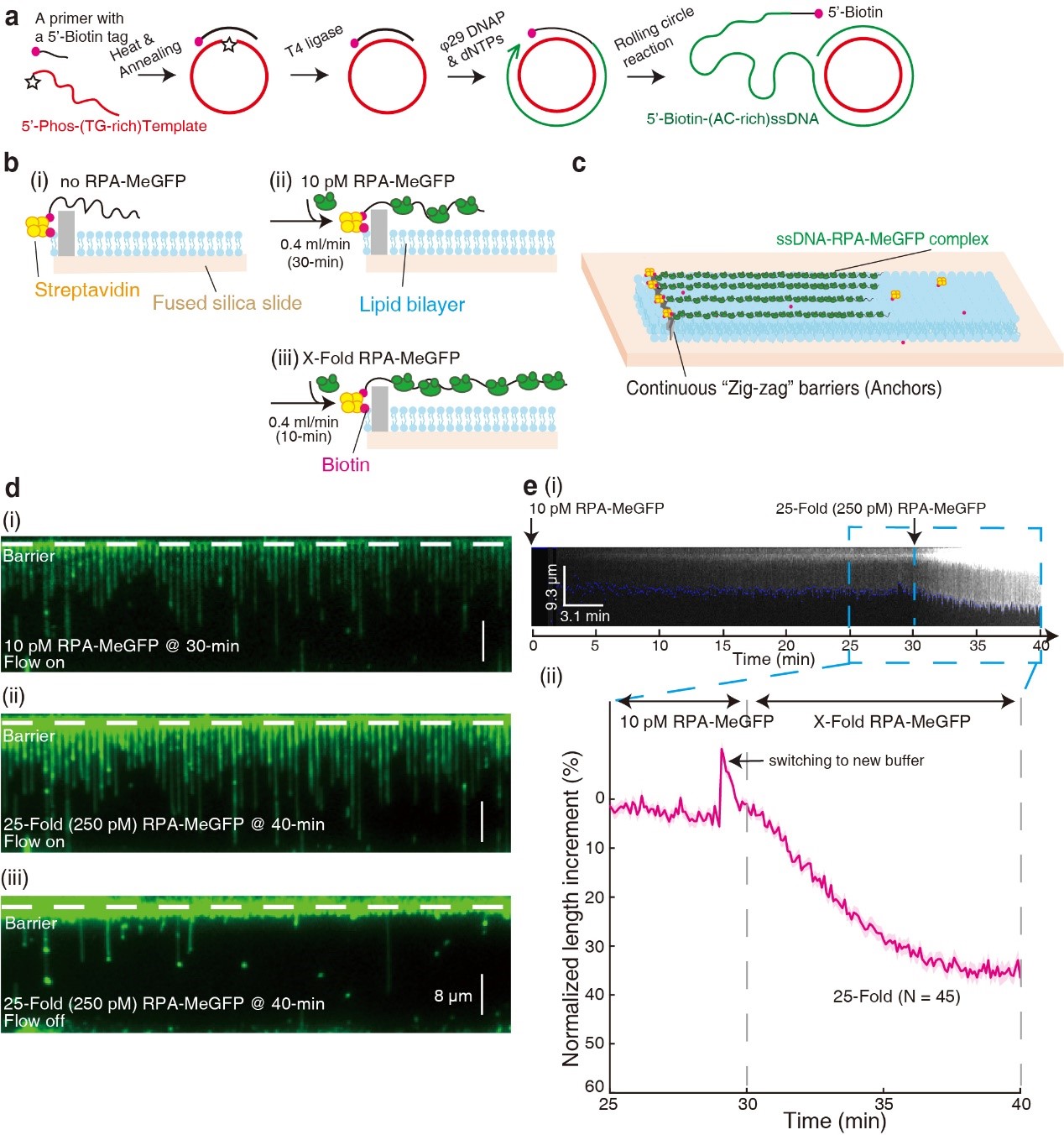
图1. 构建三步法低复杂度单链DNA帘幕技术结合长度分析研究RPA的动态结合模式。
作者进一步对RPA进行了非平衡态物理学建模,从经典的随机顺序吸附(Random sequential adsorption)模型出发,对多个RPA分子动态结合长单链DNA构建了连续时间离散马尔科夫链模型,并通过蒙特卡洛模拟对单分子实验数据进行了拟合,模拟结果能够给出RPA的两种DNA结合模式的结合常数、长单链DNA上RPA的实时结合数量和位置分布等重要信息。模拟结果表明,RPA的动态结合性质总是会留下一些裸露的单链DNA空隙(ssDNA gap),空隙大小由RPA的DNA结合模式所决定,20-nt结合模式能够减小空隙从而降低单链DNA可及性,30-nt结合模式能够保留较大的空隙从而增加单链DNA可及性。此外,作者在单分子实验中鉴定到了切除Rfa2-WH结构域的RPA的突变体(RPA-ΔWH)能够促进RPA采用20-nt结合模式,而与RPA互作的Rad52蛋白能够促进RPA采用30-nt结合模式。最后,作者利用Rad51纤维的组装特性,又设计单分子实验对理论模型给出的结果进行了验证。Rad51单体的结合活性不足以取代RPA,然而当6个或更多的Rad51在单链DNA上成核后,便能够延伸生长并取代RPA,已知Rad51单体能结合并覆盖3-nt的单链DNA,因此,该成核过程需要至少18-nt长度的裸露DNA。在作者设计的Rad51成核组装的单分子实验中,将RPA-WT换成RPA-ΔWH能够降低单链DNA可及性、抑制Rad51的成核组装,而Rad52蛋白对RPA的结合能够提高单链DNA可及性、促进Rad51的成核组装,这些结果表明Rad51在RPA覆盖的单链DNA上成核组装的效率和模型预测的≥18-nt的单链DNA空隙的出现频率成线性正相关(r2=0.9993),进一步证实了上述理论模型的结论。该论文的这些结果提供了RPA通过动态结合模式调控单链DNA可及性的全新模型(图2),并为细胞同源重组通路中Rad52蛋白介导的Rad51纤维在单链DNA-RPA复合物上的组装提供了全新机制。
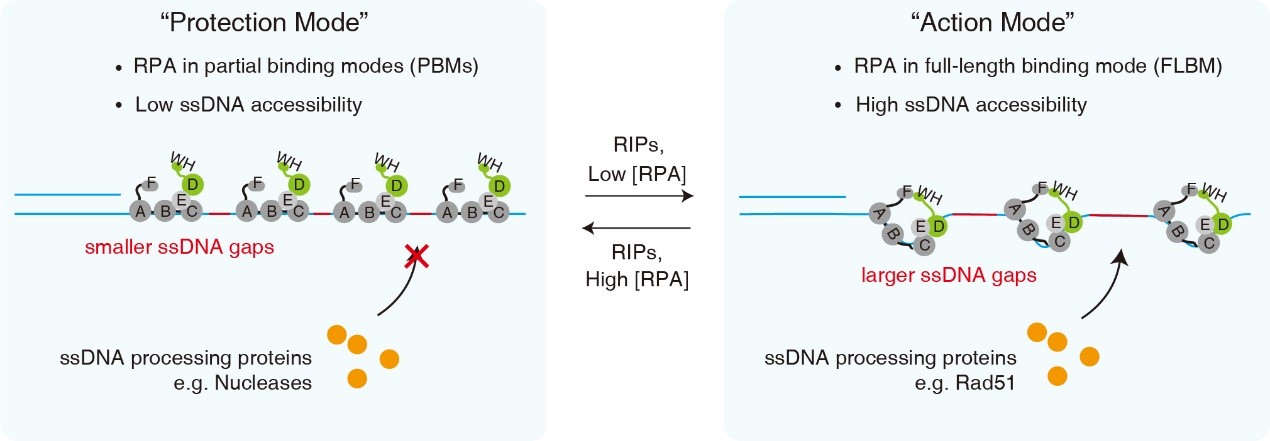
图2. RPA通过动态结合模式调控单链DNA可及性的全新模型。
北大清华生命科学联合中心博士研究生丁佳伟、美国加州大学洛杉矶分校的博士研究生李相廷、印第安纳大学博士后沈江川为该论文共同第一作者。北京大学定量生物学中心齐志研究员与印第安纳大学牛恒尧教授为该论文的共同通讯作者。北京大学定量生物学中心及化学与分子工程学院来鲁华教授、博士研究生钟书辰,北大清华生命科学联合中心赵奕玲博士(现北大医学部博士后)为该工作提供了重要帮助。北京大学生命科学学院陶乐天教授、李晴教授、美国加州大学洛杉矶分校Tom Chou教授、美国纪念斯隆-凯特琳癌症中心赵晓兰教授,以及美国哥伦比亚大学查珊教授参与课题讨论并提供建议。该研究得到了国家自然科学基金委国家杰出青年科学基金、面上项目、基础研究中心,北大-清华生命科学联合中心,National Institute of Health和American Cancer Society Research Scholar Award的资助。
北京大学前沿交叉学科研究院定量生物学中心的齐志课题组聚焦研发新型多维度、跨尺度单分子技术,并把非平衡态物理学融入交叉研究,解析生物大分子动态聚集体的分子机理:
1. 转录调控中的核酸-蛋白共凝聚物的分子机制;
2. DNA修复中的单链DNA-RPA复合物的分子机制;
欢迎已获得或短期内可获得物理、化学、生物、或工程等相关专业博士学位的有志科研之士申请博士后及科研助理职位。按照北京大学相关规定执行,提供具有国际竞争力的待遇条件,优秀者推荐申请“北大博雅博士后基金”,具体待遇面议。申请者请将个人简历发至(邮件主题请注明“博士后申请+姓名”):zhiqi7@pku.edu.cn。本招聘长期有效。
导师信息及相关个人页面:http://cqb.pku.edu.cn/qizhi/
印第安纳大学牛恒尧课题组通过生物化学和遗传学研究酵母和人细胞中的DNA损伤和修复机制,以及DNA损伤和修复过程与癌症发生的相关性。欢迎对这个领域有兴趣,有志于从事博士或博士后研究的朋友们发邮件联系(hniu@indiana.edu)。
原文链接:https://www.nature.com/articles/s41467-023-39579-y
参考文献
1 Toledo, I., Luis et al. ATR Prohibits Replication Catastrophe by Preventing Global Exhaustion of RPA. Cell 155, 1088-1103 (2013). https://doi.org:10.1016/j.cell.2013.10.043
2 Fan, J. & Pavletich, N. P. Structure and conformational change of a replication protein A heterotrimer bound to ssDNA. Genes & Development 26, 2337-2347 (2012). https://doi.org:10.1101/gad.194787.112