蛋白质与核酸在真核细胞中经相分离形成的生物大分子凝聚物是基因表达调控、胞内信号转导等关键生命活动的重要调控枢纽 (1)。现有报道的绝大多数凝聚物都具有较好的液相性质,在热力学的作用下表现为表面能最低的液滴型形貌。近年来,越来越多的工作开始讨论一些有趣的、非液滴型的凝聚物结构,如“珍珠链”结构 (2, 3)、“俄罗斯套娃”式嵌套结构 (4)、内部具有生物分子低密度腔室的空心结构 (5-7)等。其中,空心型凝聚物凭借“壳层富集-中心空置”的独特结构,在分子封装、药物递送等领域展现出巨大应用潜力 (5, 7)。然而,此类凝聚物形成的通用热力学驱动力与调控机制,长期以来一直是生物物理领域的研究谜题。

近日,北京大学定量生物学中心齐志课题组、林杰课题组联合攻关,在空心型凝聚物的物理机制研究上取得了突破性进展。研究团队以人类抑癌因子p53蛋白-双链DNA共凝聚物为研究模型,通过体外生化实验与物理模型的跨学科融合,首次揭示:在高亲和力p21 DNA的诱导下,p53与低亲和力非特异序列DNA形成的液滴型共凝聚物会通过“外周凝胶化-中心组分耗竭-旋节线分解产生稀相”的反应,实现从实心向空心结构的转变,阐明了多组分空心凝聚物形成的核心物理规律。该发现不仅填补了空心型凝聚物形成机制的理论空白,更为药物开发及生物技术应用提供了全新工具与思路。相关研究成果以 “Hollow condensates emerge from gelation-induced spinodal decomposition” 为题,发表于国际权威学术期刊PNAS。
人类抑癌因子p53蛋白具有四聚体结构、对不同序列DNA有差异化的亲和力、生理条件下无法单独形成凝聚物等特点,是凝聚物机制研究的理想模型。研究团队前期发现转录激活结构域(Transactivation domain, TAD)缺失的p53截短体能与不含p53特异结合位点、亲和力较低的随机序列DNA(Random DNA)形成实心、均质的液滴型共凝聚物;如若DNA上存在亲和力更高的p21特异序列(p21 DNA),蛋白和p21 DNA会形成不圆的珍珠链型共凝聚物 (2)。

图1. p21 DNA诱导液滴型p53-Random DNA共凝聚物转化为空心型结构
体外液滴实验发现,向已孵育成型的p53-Random DNA液滴型共凝聚物中加入p21 DNA,经过一段时间孵育,原本的实心凝聚物能够转变为三维的空心型凝聚物(图1),其中壳层区域富含p53蛋白与两种DNA,而中心腔室没有生物分子聚集,腔室内部与周围稀相的分子组成、扩散系数非常相近,证实其为真正的 “空心” 结构。作为对照,若在第二步添加Random DNA而非p21 DNA,凝聚物则始终保持均质液滴形态,表明p21 DNA与蛋白的特异性结合是凝聚物形态转变的关键因素。
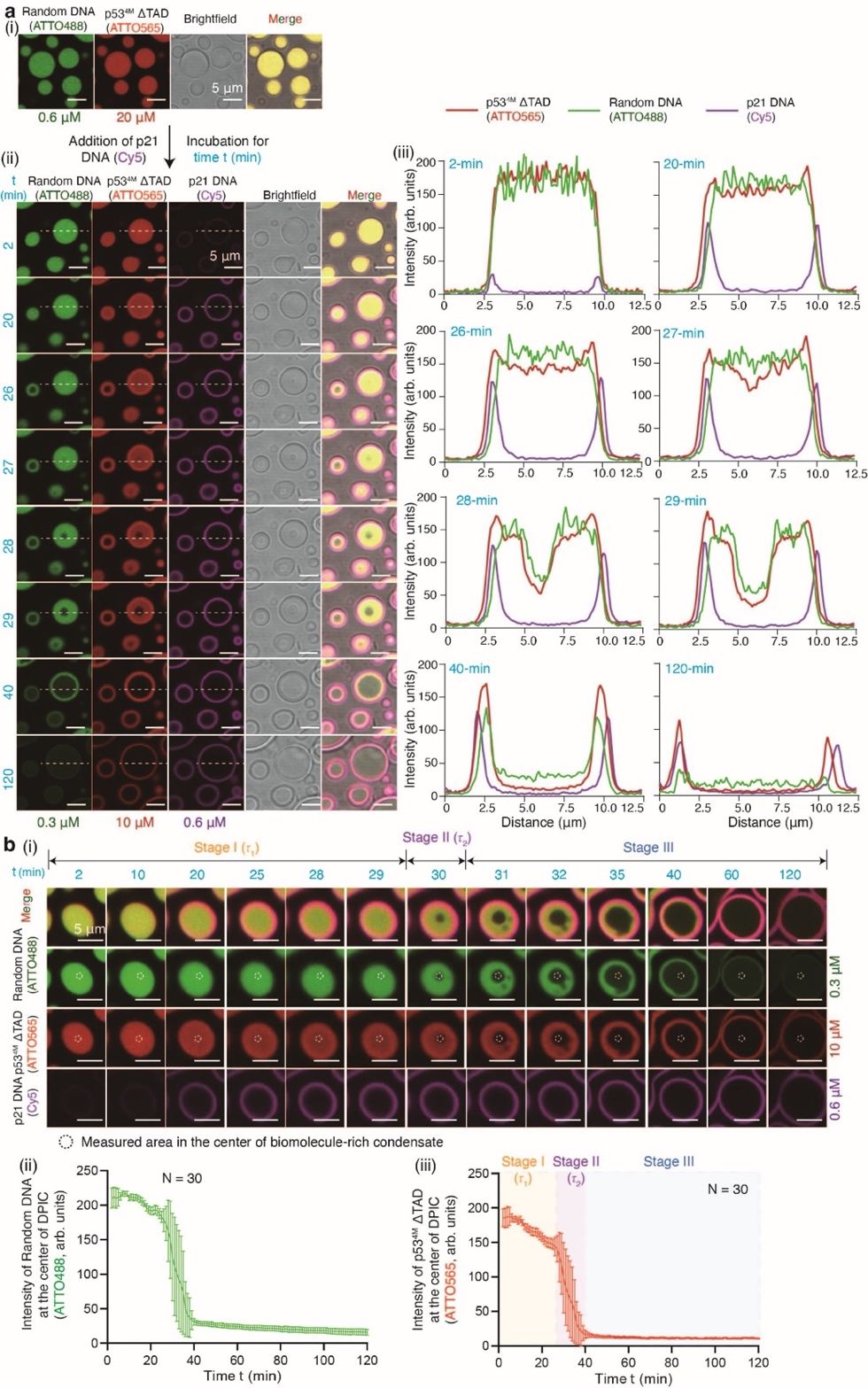
图2. p53-DNA空心型凝聚物的形成动力学
为表征空心凝聚物的形成动力学,研究团队追踪了p53蛋白与两种DNA的空间分布、荧光亮度随时间的演化(图2),发现空心结构的形成存在三个阶段:(1)阶段I:p21 DNA结合并富集在液滴型凝聚物的外周,此时凝聚物中心区域的蛋白与Random DNA浓度逐渐下降,定义该阶段的时间为τ1;(2)阶段II:中心区域蛋白与Random DNA浓度急剧下降,生物分子稀疏的腔室形成,定义该阶段的时间为τ2;(3)阶段III:空心腔室随时间扩张,空心型结构逐渐趋于稳定,壳层保持生物分子富集特性,中心腔室维持生物分子稀疏特性。
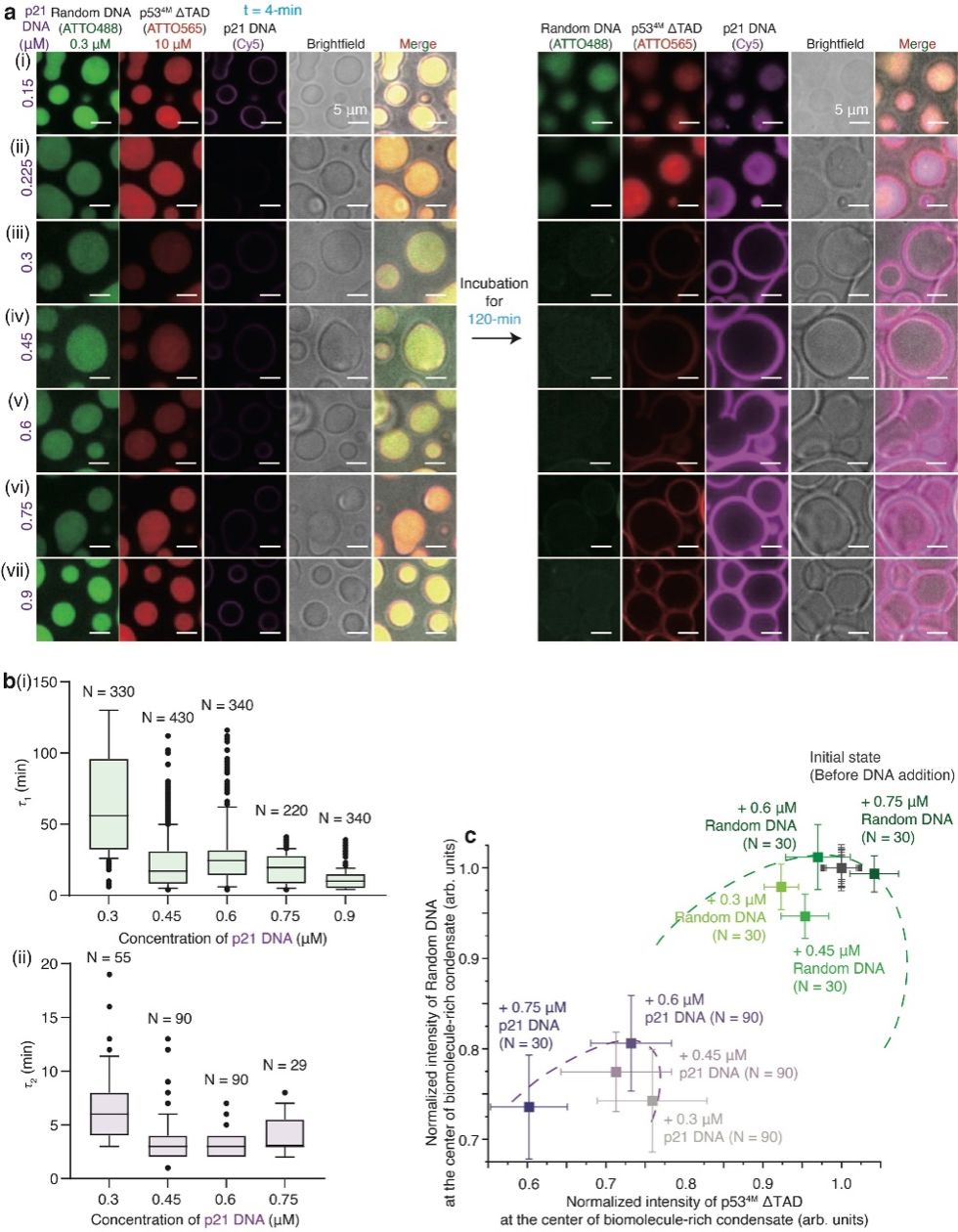
图3. p21 DNA浓度调控p53-DNA空心型凝聚物的形成
研究团队揭示了调控空心型凝聚物形成的三大核心因素:(1)提高缓冲液NaCl浓度,空心型凝聚物完全溶解,说明静电相互作用是其组装的核心驱动力;(2)改变两种DNA的添加顺序均无法形成空心结构,其仅在“p53+Random DNA先混合形成液滴,再添加p21 DNA”的条件下形成,表明组装路径的动力学调控决定凝聚物结构;(3)p21 DNA存在临界浓度阈值(图3),低于阈值无空心结构,高于阈值则稳定形成,τ1随p21 DNA的浓度升高而缩短,τ₂则保持稳定,说明p21 DNA在凝聚物外周的积累非常重要。值得注意的是,p21 DNA浓度高于阈值时,凝聚物中心的Random DNA与蛋白荧光强度在τ1结束时均显著下降,表明二者从初始稳定的浓相浓度向低浓度偏移,这暗示空心型凝聚物的形成与相分离中的旋节线分解存在联系。

图4. p21 DNA引发液滴型p53-Random DNA共凝聚物的表面凝胶化
为探究p21 DNA对初始凝聚物物态性质的影响(图4),研究团队使用了荧光淬灭恢复技术(FRAP)与原子力显微镜力谱(AFM-FS)。结果显示,空心型凝聚物壳层的p53蛋白的荧光恢复比例与速率显著低于液滴型凝聚物,且杨氏模量显著升高,表明添加p21 DNA后凝聚物由原本偏液态的状态转变为凝胶态。结合p21 DNA始终富集在凝聚物的外表面,这进一步说明凝胶化主要发生在凝聚物的表面。

图5. 引入凝胶化假设的三组分相场模型可以复现空心型凝聚物的形成
为解析空心型凝聚物的形成机制,研究团队基于实验现象,构建了包含p53蛋白、Random DNA、p21 DNA的三组分相场模型(图5)。该模型以Cahn-Hilliard动力学为基础,核心在于引入“凝胶场”变量:当局部区域的p53与p21 DNA浓度均超过临界阈值时,凝胶场产生并显著降低各组分的扩散速率,以此模拟凝聚物的外周凝胶化过程。数值模拟结果与实验高度吻合,不仅成功复现了空心型凝聚物形成的三阶段特征,其特征时间τ₁、τ₂随p21 DNA浓度的变化趋势也与实验一致。模拟与实验的高度契合为挖掘空心型凝聚物形成的核心物理机制提供了可靠的理论支撑。

图6. p53-DNA空心型凝聚物形成的物理机制
基于上述模型,研究团队通过计算体系自由能Hessian矩阵的最小特征值,追踪凝聚物中心区域的热力学稳定性随时间的演化:未添加p21 DNA时,核心区域处于稳定的浓相状态;加入p21 DNA后,伴随中心区域组分浓度下降,凝聚物进入亚稳态(阶段I);当中心区域组分浓度下降至阈值时,最小特征值跌破0,系统进入不稳定状态,触发旋节线分解(阶段II),形成新的稳定稀相即空心腔室(阶段III)。基于模拟数据绘制的相图进一步证实,旋节线分解是空心腔室形成的直接热力学驱动力,这一理论框架首次为多组分空心凝聚物的形成提供了清晰的热力学解释(图6)。
该研究在多组分生物大分子凝聚物的基础理论上实现重要突破,并展现出广阔的转化潜力。研究首次系统阐明了三组分空心凝聚物的形成机制,通过构建引入 “凝胶场” 的相场模型,精准复刻了“外周凝胶化-中心组分耗竭-旋节线分解产生稀相”的三阶段过程,揭示了盐浓度、组分添加顺序、p21 DNA浓度三大核心调控因素,明确了凝聚物组装路径的动力学调控对其形态、结构等特征的决定性作用,填补了多组分空心凝聚物形成的热力学与动力学机制空白,为理解生物大分子自组装的复杂规律提供了全新理论范式。应用技术层面,研究也为生物技术创新开辟了新路径:空心型凝聚物独特的“壳层富集-中心空置”结构有望开发出核酸药物的高效递送载体,而组分添加顺序、浓度等参数的调控规律则为人造凝聚物的理性设计与可编程组装提供了技术指导,为人类疾病的治疗干预与生物技术的创新发展带来新思路与新工具。
北京大学定量生物学中心齐志教授、林杰研究员为本文共同通讯作者。北京大学定量生物学中心李承博士后、毕业生孟令羽博士、博士生佟永鑫为本文共同第一作者。本研究获得了自然科学基金委杰青基金(T2225009 to Z.Q.),国家重点研发计划“生物与信息融合(BT与IT融合)”重点专项(2023YFF1205600),和教育部基础学科和交叉学科突破计划(JYB2025XDXM502)等项目支持。
文章链接:https://www.pnas.org/doi/10.1073/pnas.2520491122
齐志课题组(北京大学定量生物学中心):聚焦研发新型多维度、跨尺度单分子技术,并把非平衡态物理学融入交叉研究,解析生物大分子动态聚集体的分子机理:1. 转录调控中的核酸-蛋白共凝聚物的分子机制;2. DNA修复中的单链DNA-RPA复合物的分子机制;3. RNA biology中的RNA-蛋白共凝聚物的分子机制;欢迎已获得或短期内可获得物理、化学、生物、或工程等相关专业博士学位的有志科研之士申请博士后及科研助理职位。按照北京大学相关规定执行,提供具有国际竞争力的待遇条件,优秀者推荐申请“北大博雅博士后基金”,具体待遇面议。申请者请将个人简历投递zhiqi7@pku.edu.cn(应聘理由请注明“博士后申请+姓名”)。本招聘长期有效。导师信息及相关个人页面:http://cqb.pku.edu.cn/qizhi/ (联系方式:zhiqi7@pku.edu.cn)。
文献
1. S. F. Banani, H. O. Lee, A. A. Hyman, M. K. Rosen, Biomolecular condensates: organizers of cellular biochemistry. Nat Rev Mol Cell Bio 18, 285-298 (2017).
2. C. Li et al., Deciphering the molecular mechanism underlying morphology transition in two-component DNA-protein cophase separation. Structure 33, 62-77.e68 (2025).
3. W. Ma, G. Zhen, W. Xie, C. Mayr, In vivo reconstitution finds multivalent RNA–RNA interactions as drivers of mesh-like condensates. eLife 10, e64252 (2021).
4. M. Feric et al., Coexisting Liquid Phases Underlie Nucleolar Subcompartments. Cell 165, 1686-1697 (2016).
5. I. Alshareedah, M. M. Moosa, M. Raju, D. A. Potoyan, P. R. Banerjee, Phase transition of RNA-protein complexes into ordered hollow condensates. P Natl Acad Sci USA 117, 15650-15658 (2020).
6. N. A. Erkamp et al., Spatially non-uniform condensates emerge from dynamically arrested phase separation. Nature Communications 14, 684 (2023).
7. P. Wen et al., Coacervate vesicles assembled by liquid–liquid phase separation improve delivery of biopharmaceuticals. Nature Chemistry 17, 279-288 (2025).